枇杷(Eriobotrya japonica Lindl.)别名卢橘,为蔷薇科(Rosaceae)枇杷属(Eriobotrya)植物[1]。枇杷秋萌冬花,开花分3批,依开花时期,果实分为头花果、二花果和三花果。福建省农科院果树所培育的早钟6号头花果成熟期早,品质优良,错季节上市,价格高,在市场销售中占有绝对的优势,是我国目前主栽的早熟枇杷品种[2]。川早枇杷是早钟6号产生的一个自然芽变品系,2008年发现于四川省雅安市汉源县,其早熟特性优于早钟6号[3]。在雅安市汉源县栽培,川早枇杷头批花7月中下旬开放,开放早,花量大,头花果12月底陆续成熟,成熟期特早,售价最高。但因头批花花期正值高温干燥天气,大多数花因无法坐果而脱落,导致川早枇杷头花果坐果率低,产量和好果率低,成为生产上重要的限制因子[4]。
土壤水分是影响植物生长发育的重要因子,水分不足直接影响树体的生长和发育,造成减产和果实品质不佳[5-6]。枇杷是原产于中国的重要亚热带果树,需水量较大,花果期需充足水分,对土壤水分的反应比较敏感。但是其根系分布比较浅,而且多种植于丘陵山地,灌溉条件差,因此,季节性干旱成为制约枇杷提高单产的主要因素[7]。研究不同土壤水分条件下枇杷的生理反应和开花结果特性,对提高水分利用率,保障枇杷产业可持续发展具有很好的实践意义。
宋凤斌等[8]研究表明,抽穗期的玉米植株经不同强度水分胁迫处理后,花粉和花丝中SOD活性下降,膜脂过氧化作用增强,对生物膜系统产生直接伤害,花粉和花丝发育受影响,降低雌穗花丝受精能力,减少穗粒数,从而造成减产。倪书邦等[9]认为,在水分胁迫下,澳洲坚果的花粉育性、坐果率及光合产物随着水分胁迫强度的加剧而下降,处于过饱和灌溉的处理也表现为降低的结果。杨再强等[10]研究表明,重度水分胁迫使枇杷单果重显著下降。早熟枇杷头花花期正值干旱季节,但有关土壤水分对早熟枇杷头花开花结果特性和花朵保护酶活性影响的研究甚少。为此,本试验以川早枇杷为材料,探究土壤水分胁迫条件下川早枇杷头花授粉受精特性和花朵保护酶活性的相关变化规律,以期为早熟枇杷的合理灌水以及提高其头花坐果率和减轻干旱胁迫对其开花结果的影响提供参考。
1 材料和方法
1.1 试验材料
在四川省汉源县小关村枇杷园选取4年生川早枇杷树12株,2011年3月份嫁接,当年定植,砧木为枇杷本砧实生苗,生长健壮且生长势基本一致。
1.2 试验方法
试验于2015年6月在四川农业大学农场避雨棚内进行,供试土壤均采自四川农业大学农场农田。采用盆栽控水试验,每盆种1株。本试验设4个处理,每个处理重复3次:正常灌溉CK(Normal irrigation )、轻度水分胁迫LS(Mild water stress)、中度水分胁迫MS(Moderate water stress)和重度水分胁迫SS(Severe water stress),其土壤含水量分别为土壤田间持水量的85%~90%,70%~75%,50%~55%和30%~35%。称重法控制不同处理土壤水分条件,从川早枇杷小花枝轴刚分离期开始至幼果直径达到1.5 cm时为止,进行定时定量浇灌水分(每周3次,每次时间为18:00)。
1.2.1 川早枇杷头花花序和花器性状的观察 于川早枇杷头花盛花期,各处理随机选取5个花序,用游标卡尺测量并记录每个花序的长、宽,每个花序的花序支轴数、花序顶部花数以及每序花朵总数。并于盛花期各处理随机选取5朵小花,5个花蕾,进行解剖观察,用游标卡尺测量并记录花蕾长、宽,花药长、宽以及花丝和花柱长度。
1.2.2 川早枇杷头花花粉育性及柱头可授性的调查 于川早枇杷头花盛花期,各处理随机取5朵大蕾期花,剥取花药,待其干裂散粉时收集花粉,放置于干净的离心管中,贴上标签,置1~4 ℃冰箱中保存。
花粉活力测定:用TTC染色法[11-12]。取少量花粉直接放入载玻片上,加1滴0.5%TTC溶液,用镊子搅拌均匀,盖上盖玻片,置于25~30 ℃恒温箱内10~15 min。在普通光学显微镜下统计3个视野的花粉活力。花粉活力(率)=(变红的花粉个数/花粉总个数)×100%。
花粉萌发率测定[13]:于干净的载玻片上,用胶头滴管滴加已配好的10%蔗糖+0.01%硼酸+1%琼脂的固体培养基,待冷却凝固后,用毛笔蘸取花粉轻轻弹到载玻片上,置于铺上湿润纱布的培养皿内,并盖上培养皿,以防止水分过快蒸发,放在25 ℃组培室培养,12 h后在光学显微镜下统计花粉萌发率。各水分处理重复3次,取平均值。花粉萌发率(%)=(已萌发的花粉数目/花粉总数)×100%。柱头可授性及黏液分泌情况采用联苯胺-过氧化氢法[11-12]检测。
1.2.3 川早枇杷头花花朵保护酶活性的测定及坐果率的调查 于川早枇杷头花盛花期,晴天上午8:00-9:00各处理随机取5朵大蕾期花测定保护酶(SOD、POD和CAT)活性[14-16]。在川早枇杷初花期每个处理标记5个花序,并记录各花序总花朵数,并于幼果直径达1.5 cm时统计已坐果数,并计算坐果率,同时记录每盆坐果数以及每果种子数,取平均值。坐果率(%)=(坐果数/开花数)×100%。
1.3 数据处理
数据采用SPSS进行统计分析。
2 结果与分析
2.1 川早枇杷的头花花序和花器性状
在水分胁迫条件下, 川早枇杷头花花序长度和花序宽度均随土壤水分胁迫的加剧而下降,在正常灌溉CK时最长,重度水分胁迫SS时最短(表1)。与CK相比,各处理花序长度分别降低了8.06%,17.67%,37.91%,各处理花序宽度分别降低了12.05%,38.33%,47.53%,且处理SS均极显著低于CK,说明土壤重度缺水时对花序长度和宽度存在极显著的影响。花序支轴数随土壤水分减少呈降低趋势,处理LS与CK差异不显著,处理MS和SS与CK差异极显著,说明花序支轴数在土壤中度缺水时就受到极显著影响。花序顶部花数在CK时达最大数,且极显著高于其余各处理,但各处理间差异不明显,说明土壤水分对其影响极大,土壤轻度缺水时花序顶部花数就受到极显著影响。每序花朵总数随土壤水分变化存在着极显著差异,均呈降低趋势,说明每序花朵总数受土壤水分影响极大,对水分亏缺极敏感。
表1 川早枇杷的头花花序性状
Tab.1 The first florescence flower inflorescence characters of Chuanzao loquat
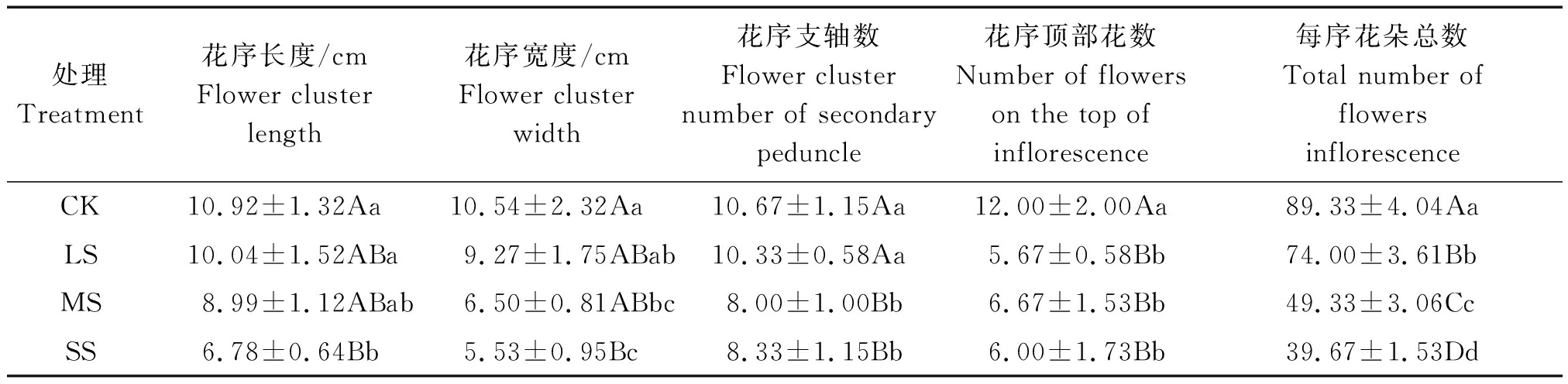
处理Treatment花序长度/cmFlower clusterlength花序宽度/cmFlower clusterwidth花序支轴数Flower clusternumber of secondarypeduncle花序顶部花数Number of flowerson the top of inflorescence每序花朵总数Total number offlowers inflorescenceCK10.92±1.32Aa10.54±2.32Aa10.67±1.15Aa12.00±2.00Aa89.33±4.04AaLS10.04±1.52ABa9.27±1.75ABab10.33±0.58Aa5.67±0.58Bb74.00±3.61BbMS8.99±1.12ABab6.50±0.81ABbc8.00±1.00Bb6.67±1.53Bb49.33±3.06CcSS6.78±0.64Bb5.53±0.95Bc8.33±1.15Bb6.00±1.73Bb39.67±1.53Dd
注:数据为平均值±标准差;CK、LS、MS、SS分别为正常灌溉、轻度水分胁迫、中度水分胁迫、重度水分胁迫;小写字母表示5%的显著水平,大写字母表示1%的显著水平。表2-4,图2同。
Notes:Values are means ± SD; CK, LS, MS and SS are normal irrigation, mild water stress, moderate water stress, severe water stress, respectively; The lowercase indicates the significant difference at 5% level,and the uppercase indicates the significant difference at 1% level.The same as Tab.2-4,Fig.2.
川早枇杷头花各花器性状对土壤水分胁迫表现出不同的反应,花器官不同,对土壤水分胁迫的反应存在着差异(表2)。花蕾长在CK时值最大且随着土壤水分的减少而降低,CK与处理LS差异不明显,但极显著大于处理MS和SS,说明轻度水分胁迫对花蕾伸长抑制不明显,中度和重度水分胁迫对花蕾伸长有强的抑制作用;花蕾宽在各处理间差异不明显,说明花蕾宽度对土壤水分反应不敏感。花药长与花药宽在CK时均达最大值,且与其余各处理间达到极显著差异,说明轻度土壤缺水就能严重影响花药的长度和宽度;花药长各处理间相比差异不显著,花药宽处理LS与处理SS相比差异达显著水平,说明在重度缺水时对花药宽的影响大于花药长。花丝长在CK时值最大并呈递减趋势,但各处理间差异不显著,说明花丝长受土壤水分影响不大。花柱长最大值为CK,最小值为处理SS;处理LS与CK相比差异不显著,处理MS和SS与CK相比差异极显著,说明土壤中度和重度缺水时对花柱伸长有极显著抑制作用。
表2 川早枇杷的头花花器性状
Tab.2 The first florescence flower characters of Chuanzao loquat cm
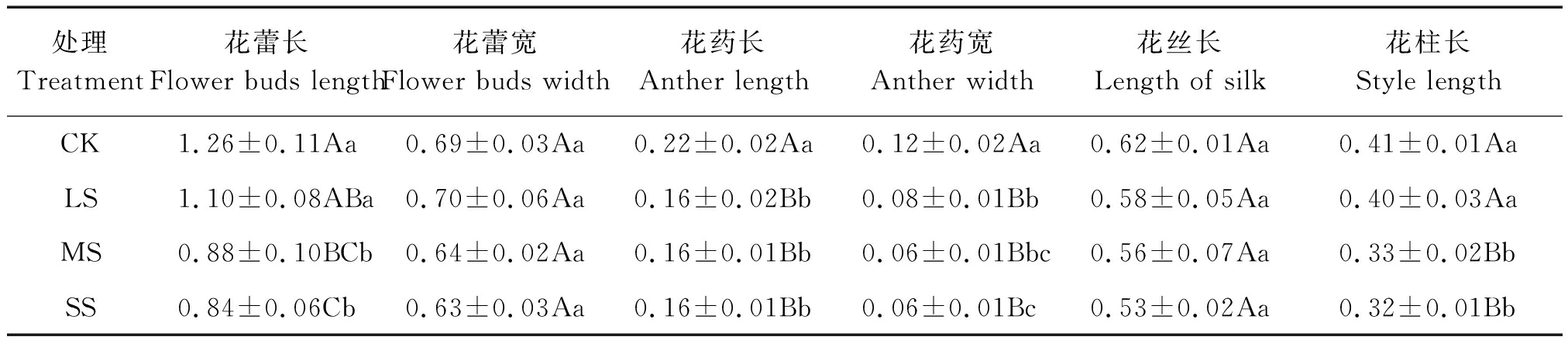
处理Treatment花蕾长Flower buds length花蕾宽Flower buds width花药长Anther length花药宽Anther width花丝长Length of silk花柱长Style lengthCK1.26±0.11Aa0.69±0.03Aa0.22±0.02Aa0.12±0.02Aa0.62±0.01Aa0.41±0.01AaLS1.10±0.08ABa0.70±0.06Aa0.16±0.02Bb0.08±0.01Bb0.58±0.05Aa0.40±0.03AaMS0.88±0.10BCb0.64±0.02Aa0.16±0.01Bb0.06±0.01Bbc0.56±0.07Aa0.33±0.02BbSS0.84±0.06Cb0.63±0.03Aa0.16±0.01Bb0.06±0.01Bc0.53±0.02Aa0.32±0.01Bb
2.2 川早枇杷的头花花粉育性及柱头可授性
具有可授性的柱头,呈现出过氧化物酶活性,此酶可催化过氧化氢的分解,释放氧气,同时使联苯胺被氧化为蓝色产物,气泡数越多,颜色越深,过氧化物酶活性越强,柱头可授性越强。由表3和图1可知,川早枇杷进行柱头可授性检验,在处理CK时,气泡数最多且有大量黏液分泌,柱头具强可授性(图1-A);在处理LS时气泡数较多,可授性较强,有黏液分泌(图1-B);随着土壤水分的减少,气泡数急剧减少,黏液分泌减少,处理MS时柱头具可授性,有很少黏液分泌(图1-C),处理SS时,柱头部分具可授性,有很少黏液分泌(图1-D)。
土壤水分对川早枇杷花粉育性的影响如表3和图1所示。花粉活力和发芽率均随土壤水分胁迫的加强而下降,各处理花粉活力与CK(图1-E)相比分别降低了17.46%(图1-F),28.35%(图1-G),52.52%(图1-H),且各处理与CK之间差异极显著;各处理花粉发芽率与CK(图1-I)相比分别降低了34.47%(图1-J),43.27%(图1-K),46.52%(图1-L),处理CK极显著大于其余各处理。说明土壤水分含量严重影响川早枇杷花粉活性,是保证川早枇杷花粉育性的重要条件。
表3 川早枇杷的头花花粉育性及柱头可授性
Tab.3 The first florescence stigma receptivity and pollen viability of Chuanzao loquat

处理Treatment柱头可授性Stigma receptivity柱头黏液分泌Mucous secretion of stigma花粉活力/%Pollen vitality 花粉发芽率/%Pollen germination percentage CK+++**68.89±3.51Aa55.33±3.43AaLS++*56.86±4.54Bb36.26±3.33BbMS+*/-49.36±3.49Bc31.39±1.35BCcSS+/-*/-32.71±4.55Cd29.59±3.97Cc
注:+/-.可授性较弱;+.可授性一般;++.可授性较强;+++.可授性强;*/-.黏液分泌很少;*.黏液分泌一般;**.黏液分泌很多。
Notes:+/-.Stigma receptivity with weakness;+.Stigma receptivity with general;++.Stigma receptivity with strong;+++.Stigma receptivity with very strong;*/-.A few mucous secretions;*. Mucous secretions;** .A lot of mucous secretions.
2.3 川早枇杷的头花花朵保护酶活性
在水分胁迫条件下,川早枇杷头花花朵的SOD、POD和CAT活性都发生变化,均随土壤水分胁迫的加强呈降低趋势(图2)。由图2-A可知,SOD活性在CK时最强,各处理的SOD活性逐渐降低,处理LS与CK相比差异不显著,处理MS和SS与CK的差异达到极显著水平。由图2-B可知,各处理的POD活性也逐渐降低,CK与处理LS、MS、SS的POD活性差异极显著,各处理间POD活性差异不大。由图2-C可知,CAT在CK时活性最强,处理 LS时次之,处理MS时最小,处理SS时又升高,且处理LS与CK相比差异显著,处理MS和SS与CK相比差异极显著。

A.CK下,柱头具强可授性(10×4);B.处理LS下,柱头具较强可授性(10×4);C.处理MS下,柱头具可授性(10×4);D.处理SS下,柱头部分具可授性(10×4);E.CK下,花粉活力高(10×4);F.处理LS下,花粉活力较高(10×4);G.处理MS下,花粉活力较低(10×4);H.处理SS下,花粉活力低(10×4);I.CK下,花粉发芽率高(10×10);J.处理LS下,花粉发芽率较高(10×4);K.处理MS下,花粉发芽率低(10×10);L.处理LS下,花粉发芽率很低(10×10)。
A.Stigma with very strong receptivity under normal irrigation;B.Stigma with quite strong receptivity under mild water stress;C.Stigma with receptivity under moderate water stress;D.Stigma with weak receptivity under severe water stress;E.Pollen with quite high vitality under normal irrigation;F.Pollen with high vitality under mild water stress;G.Pollen with low activity under moderate water stress;H.Pollen with quite low activity under severe water stress;I.Pollen with quite high germination rate under normal irrigation;J.Pollen with high germination rate under mild water stress;K.Pollen with low germination rate under moderate water stress;L.Pollen with quite low germination rate under severe water stress.
图1 不同土壤水分含量下川早枇杷头花柱头可授性、花粉活力及发芽率观察
Fig. 1 The stigma receptivity, pollen vitality and pollen germination percentage of Chuanzaoloquat in the first florescence under different soil moisture content
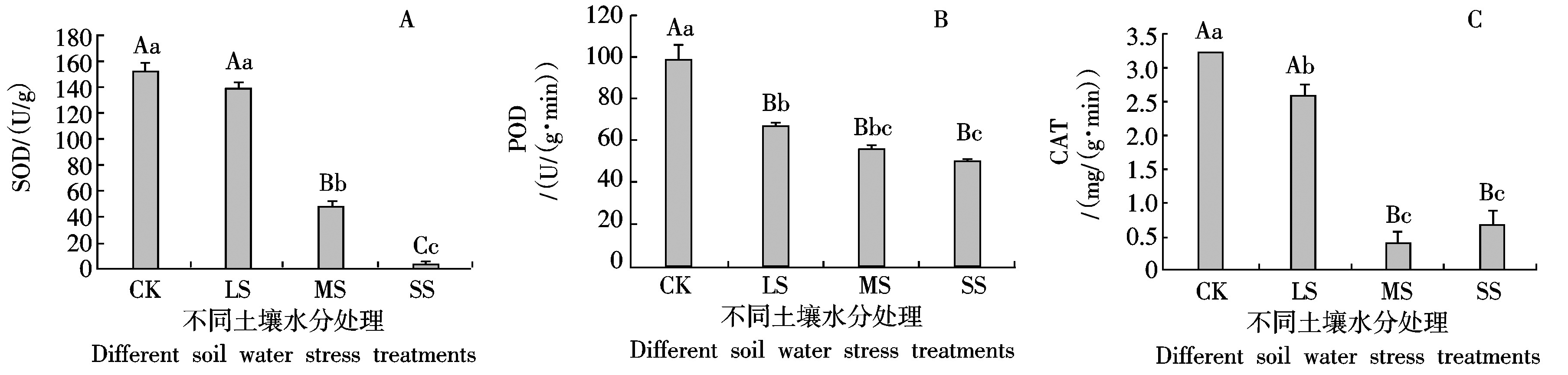
图2 川早枇杷的头花花朵保护酶活性
Fig. 2 The protective enzyme activity of Chuanzao loquat in the first florescence
SOD、POD、CAT 3种酶活性相比较,降低程度不同。SOD活性随土壤水分胁迫的加剧降低趋势最大,在处理SS时酶活性几乎丧失,说明SOD对水分胁迫反应最敏感。CAT活性随土壤水分胁迫加剧的变化趋势较SOD平缓且处理MS和SS时的CAT活性差异不明显,说明其对水分胁迫反应不如SOD敏感。随土壤水分胁迫的加剧,POD活性变化趋势最平缓,说明其对水分胁迫反应最不敏感。
2.4 川早枇杷的头花花朵坐果率
川早枇杷头花花朵坐果率随土壤水分的变化如表4所示。由表4可知,随着土壤水分胁迫的加剧,川早枇杷的平均坐果数和平均坐果率均降低,表现为:CK>LS>MS>SS。各处理与CK相比,平均坐果数分别降低40.19%,49.01%,79.41%,平均坐果率分别降低37.02%,51.21%,78.71%,均达到极显著差异水平,说明水分胁迫抑制了花粉活力,导致授粉受精不良,使坐果率降低,重度水分胁迫对其影响最大。川早枇杷种子数随土壤水分变化的表现为:LS>SS>MS>CK,只有LS和SS与CK相比,差异极显著,说明土壤水分胁迫在一定程度上影响川早枇杷种子数。
表4 川早枇杷的头花花朵坐果率
Tab.4 The fruit setting rate of Chuanzao loquat in the first florescence

处理Treatment平均坐果数/(个/盆)The average fruit number平均坐果率/%The average fruit setting rate平均种子数/个The average seed number CK68.00±2.65Aa11.13±2.62Aa1.80±0.45BbLS40.67±2.08Bb7.01±1.01Bb3.40±0.55AaMS34.67±2.52Bc5.43±1.45Bb2.60±0.55ABabSS14.00±1.73Cd2.37±0.22Cc3.20±0.84Aa
3 讨论
在果树生产中,水分是影响果树产量的一个重要因子,尤其是花期受到旱害导致减产的幅度最大[9, 17]。本试验研究中,川早枇杷头花花期经不同土壤水分处理后,花序长度和宽度在重度水分胁迫(SS)时均大幅降低,与CK差异极显著;花序支轴数和花序顶部花数随土壤水分降低而减少,分别在中度水分胁迫(MS)和轻度水分胁迫(LS)时与CK达极显著差异,最终导致每序花朵总数大幅减少。随土壤水分胁迫加剧,花蕾长,花药长、宽,花柱长均大幅缩短。说明土壤水分通过影响花朵数量和花器官发育,使处于缺水下的川早枇杷头花不具进行授粉受精的良好条件,最终导致其授粉受精不良,坐果率低,产量低。
枇杷的坐果率与柱头可授性、花粉活力及花粉管动力等密切相关[18-19]。本试验研究表明,随着土壤水分含量降低,川早枇杷头花柱头可授性及黏液分泌能力逐渐减弱,从而影响花粉的黏附和萌发,影响授粉受精和产量。而花粉能否在柱头上萌发并穿过柱头,不仅与柱头可授性有关,与花粉活力和发芽率也密切相关。张维强等[20]研究认为,在玉米植株小花分化至开花期进行轻度、中度和重度水分胁迫处理,均降低了玉米的花粉活力。本试验研究表明,各处理花粉活力及发芽率均低于CK,且与CK达到极显著差异,说明土壤水分通过影响花粉活力及发芽率对川早枇杷头花授粉受精产生影响,最终导致其授粉受精不良,结果少,产量低。
杨再强等[21]在水分胁迫对番茄保护酶活性及果实产量影响的研究中表明,随水分胁迫加剧及时间延长,叶片保护酶活性降低,膜脂过氧化作用逐渐加强,叶绿素合成受到抑制,光合产物下降,果实产量降低。本试验研究表明,随水分胁迫程度的加强,川早枇杷头花的SOD、POD、CAT活性均大幅降低,但各保护酶对水分敏感程度不同,在重度水分胁迫时,SOD活性几乎丧失,对水分胁迫敏感,POD和CAT仍具较高活性,对水分胁迫敏感程度低于SOD。由此可见,在土壤水分胁迫下,川早枇杷清除活性氧自由基的抗氧化能力是有一定限度的,水分胁迫加剧时,保护酶活性下降,活性氧的积累超过其清除能力,生物膜功能受损,造成川早枇杷生理代谢紊乱,最终影响产量。
综上,在川早枇杷头花发育的关键时期很有必要采取适当的灌溉措施。
[1] 林旗华,许奇志,郑 姗,等.枇杷种质资源坐果的遗传多样性及其相关分析[J].福建果树,2009(1):4-10.
[2] 陈志滨.早钟六号枇杷优质高效栽培技术[J].现代农业科技,2013(12):75.
[3] Mei L Y, Liao M A, Ren Y J, et al. Study on fruit quality, phenological phases and shoot histomorphology of a new bud mutant line, Chuanzao Loquat[J]. Agricultural Science and Technology, 2012,13(9):1881-1884.
[4] 鲍荣粉.川早枇杷生物学特性调查及疏果套袋对果实品质的影响[D].雅安:四川农业大学,2013.
[5] 魏瑞锋.土壤水分含量对梨枣树光合特性以及果实品质的影响[D].杨凌:西北农林科技大学,2012.
[6] 张 晓,峰韩翔,张建光.不同土壤水分含量对黄冠梨叶片光合效率和抗氧化特性的影响[J].北方园艺,2013(10):7-11.
[7] 张 燕,李 娟,姚 青,等.丛枝菌根真菌对水分胁迫下枇杷实生苗生长和养分吸收的影响[J].园艺学报,2012,39(4):757-762.
[8] 宋凤斌,戴俊英,张 烈,等.水分胁迫对玉米花粉活力和花丝受精能力的影响[J].作物学报, 1998,24(3):368-373.
[9] 倪书邦,刘建福,李道高,等.澳洲坚果花期水分胁迫效应的研究[J].西南农业大学学报, 2002,24(1):34-37.
[10] 杨再强,谢以萍,张旭东,等.水分胁迫对枇杷果实发育阶段的光合特性和果实品质的影响[J].灌溉排水学报,2007,26(6):89-92.
[11] 张 妍,杨发君,田义新.穿龙薯蓣花粉活力及柱头可授性测定方法研究[J].安徽农业科学, 2010, 38(5):2344-2346.
[12] 杨发君,张 妍,张 建,等.防风花粉活力测定方法的比较及柱头可授性的研究[J].人参研究, 2010, 22(2):22-25.
[13] 杨秀莲,向其柏.桂花花粉活力测定与晚籽银桂柱头可授性分析[J].林业科技开发, 2007, 21(3):22-25.
[14] 熊庆娥.植物生理学实验教程[M].成都:四川科学技术出版社, 2003:124-126.
[15] Jiang Y, Huang B. Drought and heat stress injury to two cool season turf grasses in relation to antioxidant metabolism and lipid peroxidation[J]. Crop Science, 2001, 41(2):436-442.
[16] 李合生.植物生理生化试验原理和技术[M].北京:高等教育出版社, 2000:258-260.
[17] 张 芮,成自勇,王旺田,等.不同生育期水分胁迫对延后栽培葡萄产量与品质的影响[J].农业工程学报, 2014, 30(24):105-113.
[18] 杨 芩.枇杷授粉受精生物学研究与S基因克隆[D].雅安:四川农业大学, 2013.
[19] 红 雨,方海涛,那 仁.濒危植物蒙古扁桃花粉活力和柱头可授性研究[J].广西植物, 2006, 26(6):589-591.
[20] 张维强,沈秀瑛,戴俊英.干旱对玉米花粉,花丝活力和籽粒形成的影响[J].玉米科学, 1993, 2(14):45-48.
[21] 杨再强,刘朝霞,韩秀君,等.水分胁迫对番茄保护酶活性及果实产量的影响[J].东北农业大学学报, 2014, 45(3):40-45.