大豆( Glycine max L.) 是我国主要的粮食与油料作物,在国民经济中占有不可替代的重要地位[1-2]。河北省常年种植大豆46.7万~53.3万hm2,是我国大豆生产大省[3]。因为肥料、农药等投入不足,造成植株抗逆、抗病性差,产量不稳定是当前影响河北大豆生产的重要因素[4]。如何通过新技术方法提高大豆植株的抗逆性、增加大豆产量,是河北大豆生产研究的一个重要方面。
植物免疫诱抗剂能够通过级联放大作用调节植物的新陈代谢,增强植物抗病和抗逆能力,最终可以达到作物增产效果,同时可以减少农药的过度使用对环境和农产品带来的污染。真菌激活蛋白(Activator protein)是新型的植物免疫诱抗剂,广泛存在于真菌孢子和菌丝体中[5],其代表产品是中国农科院邱德文教授研发的“3%极细链格孢激活蛋白可湿性粉剂”、“普绿通植物免疫蛋白粉剂”等[6]。在蔬菜、粮食作物以及大田经济作物施用研究表明,激活蛋白不仅能够通过诱导、激发、调节植物体内的一系列功能蛋白,启动植物防卫反应,激活植物的免疫系统,提高植物自身免疫力,而且通过调节植物生长代谢系统,促进植物生长,提高作物产量和产品品质[6-7]。
有关激活蛋白对大豆生长发育研究较少。前人研究分析了激活蛋白处理大豆幼苗后对根系生理、叶片生理影响,证实了一定浓度的激活蛋白处理可增强大豆幼苗根系活力和硝酸还原酶活性,提高叶片叶绿素含量及可溶性糖、可溶性蛋白的含量[8]。由于光合作用是植物生长的基础,阐明激活蛋白对植物光合特性的影响具有重要的理论和实践意义。然而,有关激活蛋白对大豆光合特性以及叶绿素荧光参数影响至今尚未见报道。因此,以极细链格孢激活蛋白作为植物免疫诱抗剂,在受控环境下开展了不同浓度植物激活蛋白对大豆光合特性、叶绿素荧光参数以及产量的影响,探讨激活蛋白在促进大豆生长发育、增加植株产量的生理功能基础,以期为应用激活蛋白实现大豆增产提供理论依据。
1 材料和方法
1.1 材料与处理设置
大豆种子冀豆17由河北省农林科学院粮油所提供,挑选大小一致、形状饱满且均匀、无虫蛀或劣变发霉的种子,浸泡在80 mmol/L过氧化氢溶液中6 h进行表面消毒,取出后用双蒸水进行冲洗,重复3~5遍[9]。然后将种子播于浇足水装有清水洗净后沙子的塑料花盆中,种植密度5苗/盆,然后将花盆移置于温室中。温室内光源系统是由红∶白=4∶1的LED提供,植物冠部光强为(500±50)μmol/(m2·s)光照周期为12 h(光)/12 h (暗),温度26 ℃(光)/22 ℃(暗)±1 ℃,相对湿度(55±10)%。每2 d每盆浇Hoagland营养液500 mL,EC值和pH值分别为2.0 dS/m和 5.5[10]。
极细链格孢激活蛋白购自北京中保绿农科技集团有限公司。先用蒸馏水将3%激活蛋白可湿性粉剂稀释成1,2,3,4,5,6 μg/mL 6个浓度。在大豆开花期时,分别用上述6个浓度的激活蛋白溶液喷雾处理,以同龄期喷清水(0 μg/mL的激活蛋白)处理为对照。在处理后的第7天进行取样,同时对大豆进行光合特性与叶绿素荧光参数的测量。在80 d后收获大豆,测量不同处理组的总生物量以及大豆产量。
1.2 叶绿素含量测定
采用Arnon法测定叶绿素含量[11]。运用紫外分光光度计(SP-752,上海光谱仪器有限公司,中国)将叶绿素丙酮溶液在663,645,440 nm波长下比色,所得的光密度(OD)值代入公式计算浸提液中叶绿素a(Chla)、叶绿素b(Chlb)、叶绿素总量(Chla+b)以及类胡萝卜素(Caro)含量的值。
1.3 光合特性测定
根据先前的文献方法[12],使用便携式光合仪(LI-6400XT,LI-COR,USA),环境 CO2浓度和光照强度均以培养条件设定为准,在不同激活蛋白处理后的第7天上午10:00测定大豆第4片真叶的净光合速率(Pn)、气孔导度(Gs)、胞间二氧化碳浓度(Ci)、蒸腾速率(Tr)等。
1.4 叶绿素荧光参数测定
使用LI-COR便携式光合作用系统(LI-6400 XRT,LI-COR,USA)测量气体交换的同时进行叶绿素荧光测量。所有叶绿素荧光参数均使用叶绿素荧光标准叶室(m=2 cm2)完成测定,荧光测量前先将待测叶子暗适应30 min。PS Ⅱ最大光化学量子效率(Optimal photochemical efficiency of PS Ⅱ,Fv/Fm)是通过最大可变荧光(Fv)与暗条件下最大荧光(Fm)比值获得。光系统Ⅱ潜在活性(Potential activity of PS Ⅱ,Fv/Fo)是通过最大可变荧光(Fv)与暗条件下最小荧光(Fo)比值获得。参考前人文献所述方法计算获得以下参数[13]:PS Ⅱ有效量子效率(Effective quantum yield of PS Ⅱ,ΦPSⅡ)、光化学猝灭系数(Photochemistry quenching,qP)、非光化学猝灭系数(Nonphotochemistry quenching,NPQ)。
1.5 数据统计
每个处理重复3次,每次重复进行3次平行测量。9次测量的平均值±标准差作为最终的结果,运用Statistical Product and Service Solutions(SPSS 20.0)软件分析,全部数据采用方差分析(ANOVA)P≤0.05,采用Turkey检验进行显著性分析。
2 结果与分析
2.1 不同浓度极细链格孢激活蛋白处理对大豆光合色素含量的影响
光合作用是植物合成有机物的重要途径,叶绿素a和叶绿素b是绿色植物光合作用的主要色素和辅助色素,它们含量高低可以反映植物光合能力的大小[14]。如图1所示,随着极细链格孢激活蛋白浓度的增加,叶绿素a、b与总量的变化均表现出先上升后下降的趋势,而且在3,4 μg/mL的激活蛋白浓度下,其值达到最大,与对照处理相比,叶绿素a、叶绿素b含量和叶绿素总量分别增加33%~40%,37%~39%和35%~40%。在施用较低浓度(1~2 μg/mL)的激活蛋白时,叶绿素a含量的增幅明显大于叶绿素b含量(图1-A、B),这表明叶绿素a对极细链格孢激活蛋白浓度变化的响应比叶绿素b更为敏感。当施用极细链格孢激活蛋白浓度达到了6 μg/mL时,大豆的叶绿素含量迅速下降,极细链格孢激活蛋白对大豆叶绿素a、叶绿素b的含量促进效果完全消失(图1-A、B)。不同浓度的极细链格孢激活蛋白处理下大豆胡萝卜素含量变化很小,并不存在统计学差异(P>0.05,图1-D)。
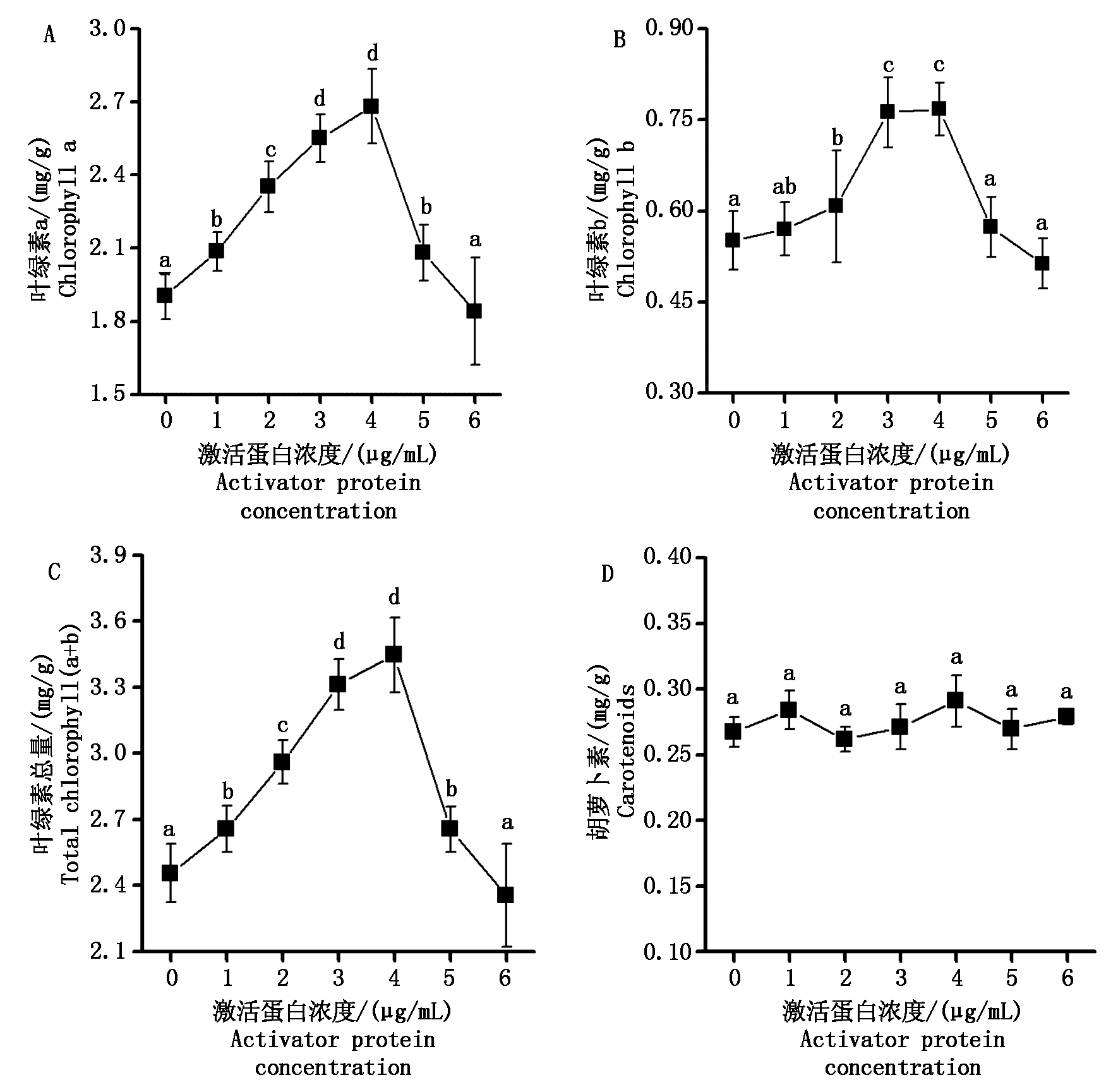
不同的字母表示不同处理间差异显著,P<0.05。图2-4同。
Different letters are significantly different at P<0.05.The same as Fig.2-4.
图1 不同浓度极细链格孢激活蛋白处理后的大豆叶绿素a含量(A)、叶绿素b含量(B)、总叶绿素含量(a+b)(C)、类胡萝卜素含量(D)
Fig.1 Chlorophyll a (A),chlorophyll b (B),chlorophyll(a+b)(C),and carotenoids (D) of soybean after spraying different concentrations of activator protein from Alternaria tenuissima
2.2 不同浓度极细链格孢激活蛋白处理对大豆的光合特性影响
图2表示的是不同浓度极细链格孢激活蛋白处理7 d后的大豆叶片光合特性参数的变化。从图2-A 可以看出,随着极细链格孢激活蛋白浓度的不断升高,大豆光合速率(Pn)呈现先增加后下降的趋势。与对照组相比,大豆叶片喷洒极细链格孢激活蛋白浓度为1,2,3,4 μg/mL的 4个处理组,光合速率分别增加了13%,16%,52%,54%,而在使用浓度为5,6 μg/mL的2个处理组光合速率反而下降到对照水平甚至更低。各处理叶片的气孔导度(Gs)变化与光合速率(Pn)基本相似,呈现先增加后下降的趋势(图2-B)。施用3,4 μg/mL的极细链格孢激活蛋白处理后大豆气孔导度达到最高,比对照分别提高了30%和38%,这说明合适浓度激活蛋白处理(2~4 μg/mL)明显降低了大豆的叶片气孔阻力,提高了气孔导度。不同浓度激活蛋白处理后的大豆叶片胞间CO2浓度(Ci)的变化基本与光合速率(Pn)存在一定程度上相反的现象(图2-C)。在3,4 μg/mL极细链格孢激活蛋白处理组大豆光合速率达到最高,其Ci却显著降低了14%~20%。从图2-D 可知,不同浓度极细链格孢激活蛋白处理后的大豆叶片蒸腾速率(Tr)的变化基本与气孔导度(Gs)的变化类似,即随着施用激活蛋白浓度的增加,呈现先增加后下降的趋势,说明了大豆的蒸腾速率变化与气孔导度有关。2~4 μg/mL的激活蛋白处理后大豆蒸腾速率有明显的提高,与对照比分别增加13%,21%和25%。
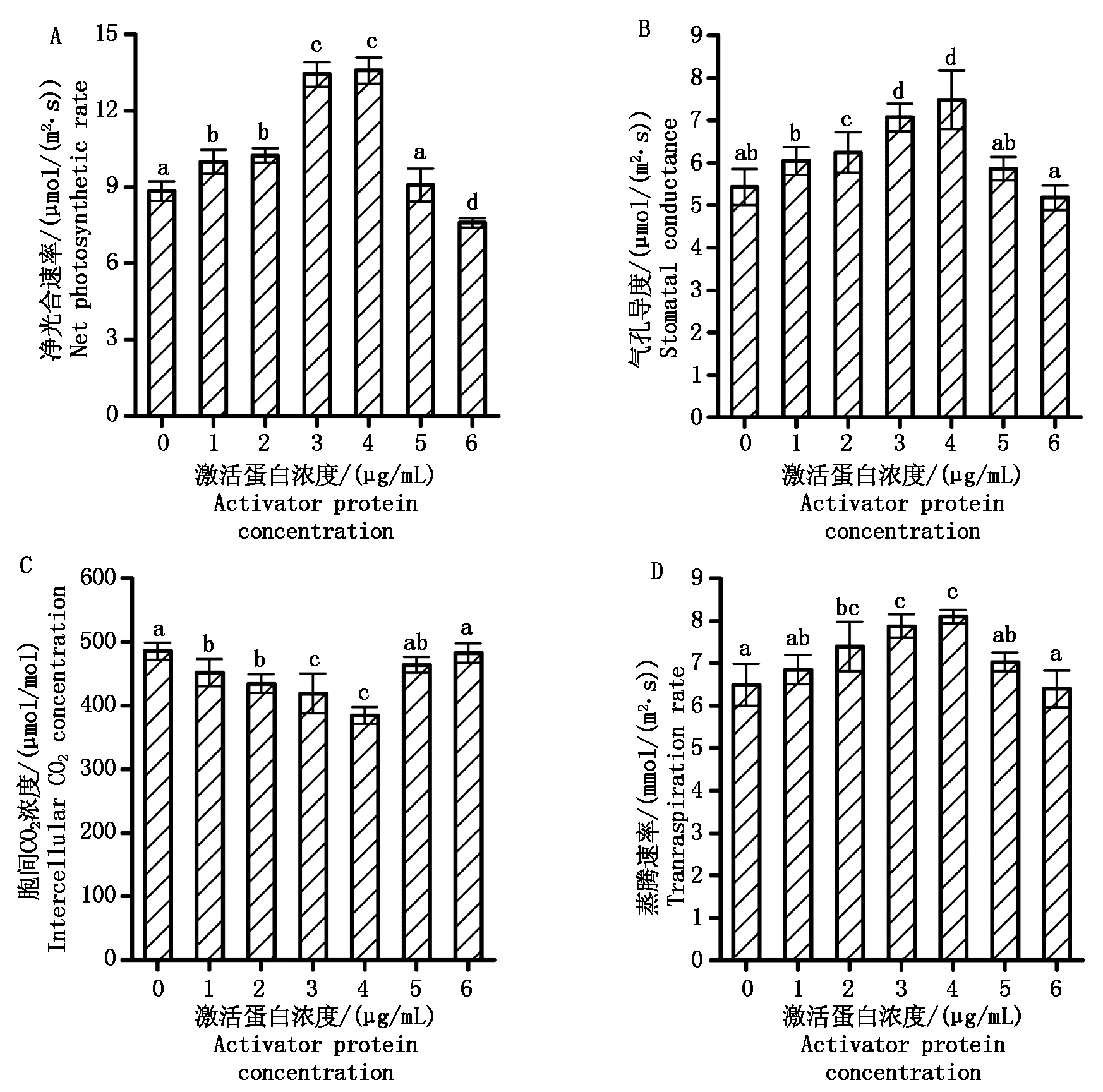
图2 不同浓度极细链格孢激活蛋白处理后的大豆叶片净光合速率(A)、气孔导度(B)、胞间CO2浓度(C)、蒸腾速率(D)
Fig.2 Net photosynthetic rate (A),stomatal conductance (B),intercellular CO2 concentration (C) and transpiration rate (D) of soybean after spraying different concentrations of activator protein from Alternaria tenuissima
2.3 不同浓度极细链格孢激活蛋白处理对大豆叶绿素荧光参数的影响
PS Ⅱ最大光化学量子效率(Fv/Fm)值越大,说明PS Ⅱ反应中心的能量捕捉效率越高[13]。PSⅡ实际光化学效率(ΦPS Ⅱ)值越高越有利于提高叶肉细胞的光合能力和植物的光合效率,为暗反应的碳同化积累更多的能量[15]。如图3-A、B所示,喷洒极细链格孢激活蛋白处理组,大豆叶片的Fv/Fm和ΦPS Ⅱ值呈现先升高后下降趋势,3,4 μg/mL的激活蛋白处理组显著高于对照组(P<0.05),其Fv/Fm和ΦPS Ⅱ值分别较对照提高了5.4%,28.0%以及5.6%,32.0%。而喷洒5,6 μg/mL的激活蛋白处理组与对照间不存在显著性差异(P>0.05)。喷洒1,2 μg/mL激活蛋白处理效果介于3,4 μg/mL处理组与5,6 μg/mL处理组之间。光化学猝灭系数(qP)越大表明PS Ⅱ开放的反应中心所占比例越大,PSⅡ的电子传递活性越高;而非光化学猝灭系数(NPQ)越小,表明植物吸收的光能中以非辐射能量耗散越小[16-17]。如图3-C、D所示,随着施用极细链格孢激活蛋白浓度的提升,qP先升高后下降,而NPQ则是先下降后升高。qP与NPQ在中等浓度(3,4 μg/mL)的激活蛋白处理下分别达到最大值与最小值,与对照组之间的差异达到了显著水平(P<0.05)。施用低浓度(1,2 μg/mL)的激活蛋白也能提高qP,降低NPQ,但其效果明显低于中等浓度的处理组。而施用高浓度(5,6 μg/mL)激活蛋白处理组其qP、NPQ与对照组之间不存在显著性差异(P>0.05)。
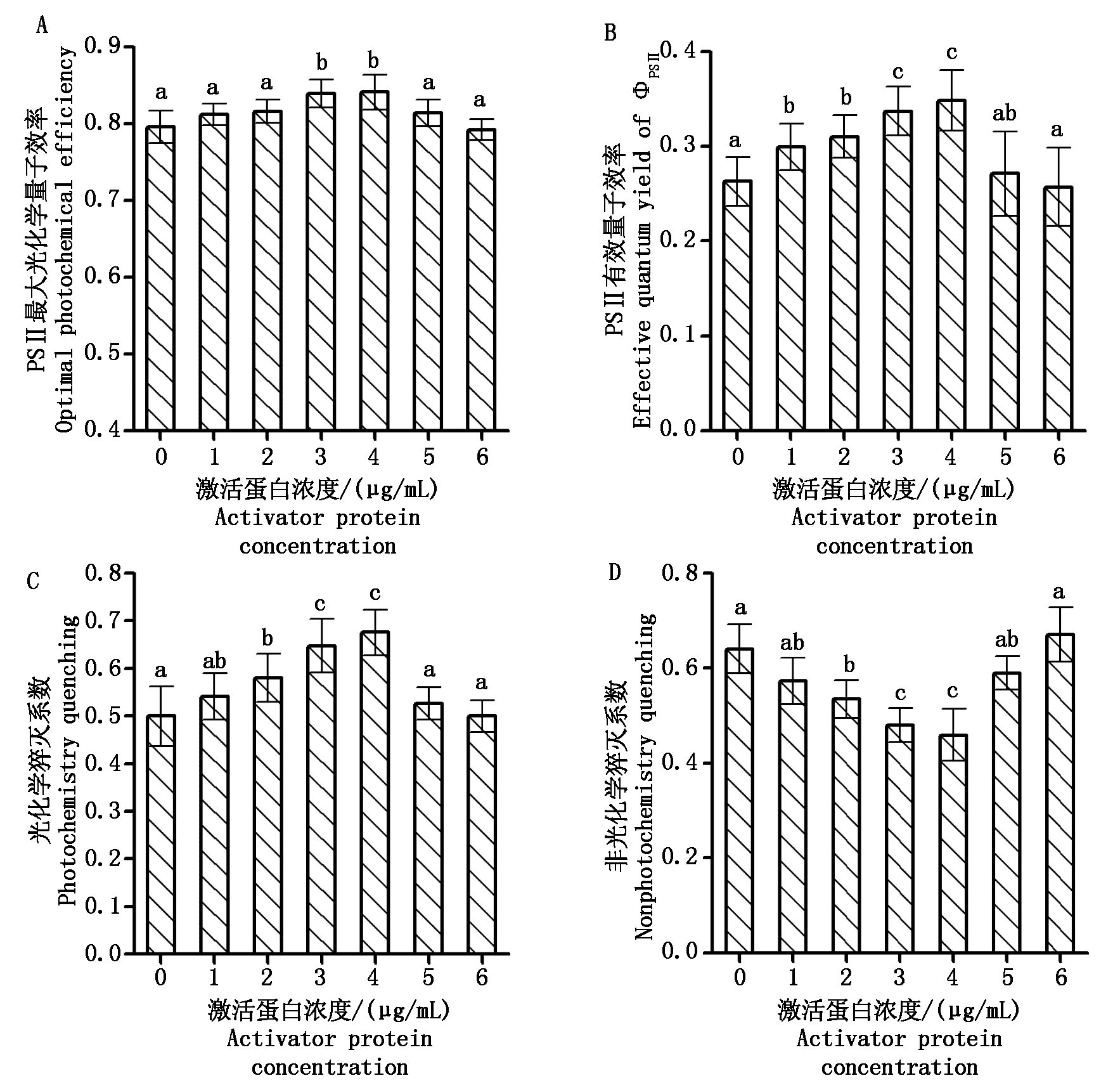
图3 不同浓度极细链格孢激活蛋白处理后的大豆叶绿素荧光参数
Fig.3 Chlorophyll fluorescence parameters of soybean after spraying different concentrations of activator protein from Alternaria tenuissima
2.4 不同浓度极细链格孢激活蛋白处理对大豆产量的影响
如图4所示,与对照相比,喷施极细链格孢激活蛋白明显增加了大豆的总生物量与大豆产量(以干质量计)。这说明激活蛋白的施用确实促进了大豆的生长,有利于植株茁壮,最终提高了大豆种子的产量。同时也发现,不同的极细链格孢激活蛋白浓度对大豆的增产效果存在差异。与对照相比,大豆施用1~6 μg/mL的激活蛋白处理后的产量分别增加了6.89%,6.03%,11.21%,14.76%,4.83%以及3.43%(图4-B)。这一结果也印证了本研究前面有关喷施极细链格孢激活蛋白对大豆光合特性、叶绿素荧光参数影响的试验结果。
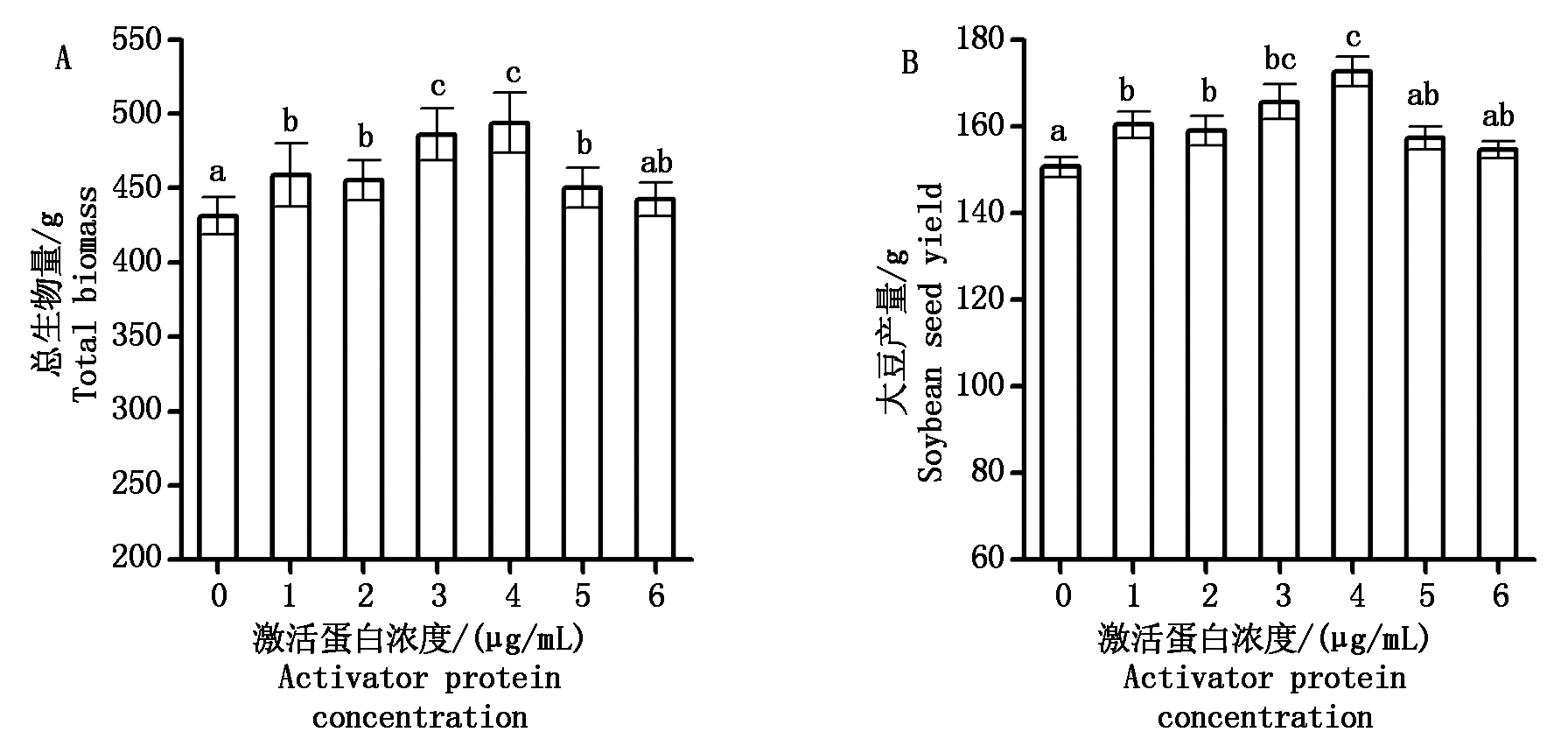
图4 不同浓度极细链格孢激活蛋白处理组的大豆总生物量(A)与产量(B)
Fig.4 Total biomass (A) and seed yield (B) of soybean after spraying different concentrations of activator protein from Alternaria tenuissima
3 讨论与结论
随着极细链格孢激活蛋白施用浓度的增加,大豆的叶绿素含量变化明显,胡萝卜素含量并不明显。先前的研究已经证明了施用多效唑、细胞分裂素等植物生长调节剂可以增加叶绿素合成速率,降低叶绿素降解速率,在延缓叶片衰老以及生理功能方面发挥了重要作用[18-20]。本研究表明,施用具有抗病促生作用的极细链格孢激活蛋白进行诱导处理同样可以有效地提高大豆的叶绿素含量。激活蛋白本身具有生长调节的功能,能够诱导影响细胞内的激素平衡,从而调节生长代谢,并在一定程度上延缓叶片的衰老和光合功能衰退,延长叶片的光合功能期[21-22] 。这可能是极细链格孢激活蛋白使用后大豆叶绿素提高的原因。武广衍等[8]的研究表明,与对照组相比,当施用2,5 μg/mL激活蛋白处理后大豆幼苗叶绿素含量分别增加了17.32%和5.32%,高浓度的激活蛋白处理反而降低了激活蛋白对叶绿素含量的增加效果。本试验结果再一次印证了这一观点:在适当浓度条件下,激活蛋白可以提高植物的叶绿素含量,增强其光合作用,浓度过高这种效果将消退。大多的研究结果表明,胡萝卜素对外源诱导处理的响应敏感程度低于叶绿素[23-25]。因此,大豆胡萝卜素对激活蛋白低敏感度可能是造成其含量并未发生明显变化的原因。
随着施用的极细链格孢激活蛋白浓度的增加,大豆的光合特性出现了明显的变化。大豆的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)的变化一致,呈现先上升后下降的趋势,而胞间二氧化碳浓度(Ci)则是呈现先下降后上升的趋势。由此我们可以发现,一定浓度极细链格孢激活蛋白不仅可以提高叶绿素的含量而且也可以增加叶片Gs,从而促进了叶片Pn的上升。先前的研究表明,在有光暗周期下,Tr的上升与增大的Gs紧密相关,Tr随气孔开度增大而线性增加[26]。本研究结果与先前有关Tr的变化主要受Gs的控制等结果一致。当Pn提高时,叶肉细胞固定的CO2增多,从而造成了Ci 降低 [27-28]。这种现象表明了施用一定浓度(3~4 μg/mL)激活蛋白对大豆积累有机物的能力产生了明显的促进作用,为大幅增产奠定了光合生理基础。然而,随着激活蛋白浓度的进一步提高,则会减弱这种促进效应。这与先前的研究报道类似:随激活蛋白浓度的增加,大豆幼苗的根系活力、硝酸还原酶活性、叶绿素含量等各生理指标的活性或含量呈先上升后下降的趋势[8]。但是,具有明显抛物线式的光合作用调节效果背后的机理仍然需要进一步的研究解析。
此外,随着施用的极细链格孢激活蛋白浓度的增加,最大光化学量子效率(Fv/Fm)、有效量子效率(ΦPSⅡ)和光化学猝灭系数(qP)等叶绿素荧光参数指标均呈先上升后下降的趋势。其中以中浓度(3,4 μg/mL)的处理效果最好,这些结果表明,施用适当浓度极细链格孢激活蛋白为大豆的生长提供了非常好的生长环境,降低了植株生长的逆境胁迫压力。这与施用与微生物肥料的效果类似[29],有利于大豆的茁壮生长,最终提高了大豆种子的产量。
总体上,在开花期,喷洒3,4 μg/mL浓度的极细链格孢激活蛋白能够显著地促进大豆光合特性与叶绿素荧光指标,降低外界环境对大豆植株的光合生理胁迫,最终提高了大豆的产量,是一种促进大豆增产的有效措施。
[1] 王连铮,王金陵.大豆遗传育种学[M].北京:科学出版社,1992.
[2] 吉林省农业科学院.中国大豆育种与栽培[M].北京:农业出版社,1987.
[3] 张孟臣,刘兵强,赵双进,等.发挥优势振兴河北大豆产业[J].河北农业科学,2003,7(3):61-63.
[4] 顾乃杰,胡铁欢,李雅静,等.影响河北大豆生产因子及解决方法[J].农业开发与装备,2014(12):43-43,66.
[5] 麦麦提艾力·热合曼.灰葡萄孢菌激活蛋白的纯化与功能研究[D].乌鲁木齐:新疆农业大学,2014.
[6] 王陈官菊,厉晓腊,金轶伟,等.植物激活蛋白对大棚草莓产量及品质的影响[J].农业科技通讯,2015(7):125-128.
[7] 李国华,苏 娟,余忠平.大豆应用植物激活蛋白效果[J].现代化农业,2009(4):14.
[8] 武广衍,邱德文,杨秀芬,等.新型真菌源激活蛋白对大豆幼苗生理特性的影响[J].大豆科学,2007,26(5):691-694.
[9] He L H,Gao Z Q,Li R Z.Pretreatment of seed with H2O2 enhances drought tolerance of wheat (Triticum aestivum L.) seedlings[J].African Journal of Biotechnology,2009,8(22):6151-6157.
[10] Wheeler R M,Mackowiak C L,Stutte G W,et al.Crop productivities and radiation use efficiencies for bioregenerative life support[J].Advances in Space Research,2008,41(5):706-713.
[11] 徐国瑞,刘济明,闫国华,等.罗甸小米核桃叶绿素含量测定方法研究[J].山地农业生物学报,2010,29(5):419-423.
[12] Silva E N,Ferreira-Silva S L,Fontenele A D,et al.Photosynthetic changes and protective mechanisms against oxidative damage subjected to isolated and combined drought and heat stresses in Jatropha curcas plants[J].Journal of Plant Physiology,2010,167(14):1157-1164.
[13] Maxwell K,Johnson G N.Chlorophyll fluorescence-a practical guide[J].Journal of Experimental Botany,2000,51(345):659-668.
[14] Koç M,Barutçular C,Genç I.Photosynthesis and productivity of old and modern durum wheats in a Mediterranean environment[J].Crop Science,2003,43(6):2089-2098.
[15] Genty B,Briantais J M,Baker N R.The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence[J].Biochimica et Biophysica Acta (BBA)-General Subjects,1989,990(1):87-92.
[16] Lu Q T,Li W H,Jiang G,et al.Studies on the characteristics of chlorophyll fluorescence of winter wheat flag leaves at different developing stages[J].Acta Botanica Sinica,2001,43(8):801-804.
[17] 张旺锋,勾 玲,王振林,等.氮肥对新疆高产棉花叶片叶绿素荧光动力学参数的影响[J].中国农业科学,2003,36(8):893-898.
[18] 王 磊,任树梅,毕勇刚,等.土壤水分及有机肥料对番茄叶片光合特性及叶绿素含量影响的试验研究[J].灌溉排水学报,2004,23(2):66-68,80.
[19] 钟瑞春,陈 元,唐秀梅,等.3种植物生长调节剂对花生的光合生理及产量品质的影响[J].中国农学通报,2013,29(15):112-116.
[20] 董 倩,王 洁,庞 曼,等.生长调节剂对黄连木光合生理指标和荧光参数的影响[J].西北植物学报,2012,32(3):484-490.
[21] 邱德文.生物农药研究进展与未来展望[J].植物保护,2013,39(5):81-89.
[22] 张志刚,官春云,邱德文,等.细极链格孢菌蛋白激发子对棉株光合特性的影响[J].湖南农业大学学报:自然科学版,2008,34(1):1-5.
[23] 颜晓艺,赵 丹,吴承祯,等.4种诱导剂对雷公藤幼苗叶片生长及内酯醇含量的影响[J].应用与环境生物学报,2015(4):607-615.
[24] 于 敏,王文国,王胜华,等.外源柠檬酸对水稻铜毒害的缓解效应[J].应用与环境生物学报,2010(5):617-621.
[25] 王友保,刘登义.污灌对作物生长及其活性氧清除系统的影响[J].环境科学学报,2003,23(4):555-557.
[26] Wheeler R M,Mackowiak C L,Yorio N C,et al.Effects of CO2 on stomatal conductance:do stomata open at very high CO2 concentrations?[J].Annals of Botany,1999,83(3):243-251.
[27] 张瑞朋,付连舜,佟 斌,等.氮素对12个大豆品种叶片光合生理参数的影响[J].种子,2015,34(4):16-19.
[28] 杨 军,马振峰,刘桂华.钾营养对柰李叶片光合作用及叶绿素荧光的影响[J].中国农学通报,2010,26(20):238-244.
[29] 张朝轩,杨天仪,吴淑杭,等.微生物肥料对土壤生态及葡萄叶片叶绿素荧光特性的影响[J].天津农业科学,2011,17(1):92-95.