单核细胞增生李斯特菌(Listeria monocytogenes,LM)属于李斯特菌属革兰氏阳性无芽胞胞内寄生菌,属人兽共患的重要病原菌,人及动物感染后主要表现为败血症、脑膜脑炎、流产和单核细胞增多等症状,引起较高的死亡率,是世界卫生组织(World Health Organization,WHO)规定的四大食源性致病菌之一[1-2]。
非编码RNA(non-coding RNA,ncRNA)能够通过转录水平、转录后水平和翻译水平调节细菌环境应激及毒力相关基因表达以调节细菌众多的生理代谢及致病过程。目前,研究表明革兰氏阴性菌中大部分ncRNA发挥作用依赖于Hfq蛋白,该蛋白通过分子伴侣的方式参与大部分ncRNA对毒力基因及环境应激相关基因的表达调控过程。革兰氏阳性菌中大部分ncRNA发挥作用时并不需要Hfq蛋白的参与,甚至在一些革兰氏阳性菌中并不存在Hfq蛋白的同系物,这就表明在不同细菌中Hfq蛋白发挥作用的方式并不相同[3-6]。在LM中目前只鉴定到LhrA、LhrB、LhrC 3种可以与Hfq蛋白结合的ncRNA[7-8],而其余众多的ncRNA与Hfq蛋白的相互作用关系及Hfq蛋白在LM中发挥的具体作用及作用机制还有待于进一步研究。因此,本试验通过对LM hfq基因缺失株毒力、溶血活性、生物被膜生成能力的检测,以期进一步了解hfq基因在LM毒力及生物被膜生成中的作用。
1 材料和方法
1.1 菌株与试验动物
单核细胞增生李斯特菌野毒株LM-SB5由石河子大学动物科技学院动物疾病防控兵团重点实验室从发病绵羊体内分离鉴定后保存;单核细胞增生李斯特菌hfq基因缺失株LM-Δhfq由本实验室构建保存;8周龄的昆明系小鼠由石河子大学实验动物中心提供;绵羊全血采自石河子大学试验站。
1.2 小鼠半数致死量LD50检测
将LM-SB5及LM-Δhfq分别接种于BHI液体培养基中,置于37 ℃恒温条件下培养,当OD600至0.6时,12 000 r/min离心2 min收集菌体,弃去上清后用PBS缓冲液将菌体清洗2遍,10倍梯度稀释。将100只8周龄昆明系小鼠随机平均分成2组,每组分为5个梯度,分别给每只小鼠腹腔注射0.5 mL不同稀释梯度的菌液,观察小鼠精神状态及临床症状,连续观察7 d后统计各组小鼠死亡率,利用寇氏法计算LM-SB5及LM-Δhfq对小鼠的半数致死量LD50。
1.3 肝脏、脾脏载菌量及病理变化检测
将8周龄昆明系小鼠随机分成3组,通过腹腔注射亚致死剂量的LM-SB5及LM-Δhfq菌液各0.5 mL,同时设置对照组,对照组腹腔注射0.5 mL PBS缓冲液,以注射菌液当天开始,计为t=0 d,每组分别在t=1~5 d各取1只小鼠摘取其肝、脾,加入1.0 mL PBS充分研磨,10倍梯度稀释后吸取不同稀释梯度的组织研磨液涂布于BHI平板固体培养基上,置于37 ℃恒温培养箱中培养24 h计数,每个稀释梯度设置3个重复,最后以平均值作为肝、脾载菌量。在t=5 d时分别摘取3组小鼠的肝、脾、肾,经4%甲醛溶液固定制备切片,HE染色后观察其组织病理学变化。
1.4 溶血试验
将LM-SB5及LM-Δhfq 分别接于BHI液体培养基中于37 ℃条件下培养过夜,取1 mL菌液12 000 r/min离心5 min,取上清,用PBS缓冲液调整OD600至相同大小,取70 μL上清液用pH值6.0的PBS缓冲液倍比稀释至2-8,加入30 μL 1% 红细胞,观察LM-SB5及LM-Δhfq溶解红细胞情况,测定溶血效价。
1.5 hfq基因缺失对LM生物被膜生成能力的影响
将LM-SB5及LM-Δhfq菌液以1∶100的比例分别接于BHI液体培养基中培养,使其OD600值达到0.2,吸取菌液200 μL加入到96孔微孔板中,每个样品分2组,每组设置8个平行重复,将微孔板周围封闭,静置于37 ℃条件下分别培养24,48 h;弃去孔中的培养基,加入200 μL无菌蒸馏水洗涤3次,除去尚未形成生物被膜的浮游菌体,室温干燥45 min,然后向每个孔中加入150 μL 1%的结晶紫溶液在室温条件下染色30 min,弃去染色液,再用200 μL无菌蒸馏水洗涤微孔板4次,室温条件下干燥30 min;再加入150 μL浓度为95%乙醇脱色30 min,用酶标仪测定其OD570;将脱色后的微孔板直接放在倒置显微镜下观察生物被膜的形态,选取最佳视野拍照记录。
2 结果与分析
2.1 LM-SB5及LM-Δhfq的LD50检测结果
分别给小鼠腹腔注射LM-SB5和LM-Δhfq菌液后进行观察及LD50测定,在24 h后部分小鼠开始死亡,病理剖检发现在2组小鼠中肝、脾明显肿大,肠道黏膜脱落,部分肠道充血和出血,未死亡的小鼠出现结膜炎、消瘦、被毛杂乱等症状。观察7 d后统计死亡率,根据寇氏法计算得到LM-SB5和LM-Δhfq对小鼠的LD50分别为105.560,106.343 cfu(表1),LM-Δhfq的LD50升高了6.067倍,说明了hfq基因缺失引起LM毒力显著下降(P<0.05),表明hfq基因对LM的毒力具有重要调控作用。
表1 LM-SB5与LM-Δhfq的LD50测定结果
Tab.1 LD50 measurement results of LM-SB5 and LM-Δhfq
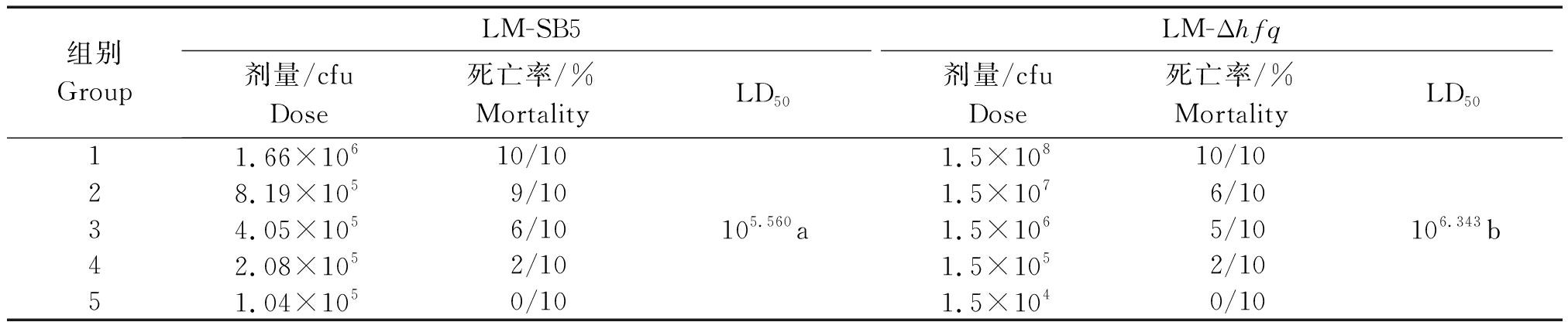
组别GroupLM-SB5剂量/cfuDose死亡率/%MortalityLD50LM-Δhfq剂量/cfuDose死亡率/%MortalityLD5011.66×10610/101.5×10810/1028.19×1059/101.5×1076/1034.05×1056/10105.560a1.5×1065/10106.343b42.08×1052/101.5×1052/1051.04×1050/101.5×1040/10
注:半数致死量LD50数值后不同小写字母表示差异显著(P<0.05)。
Note:Values of 50% lethal dose with different small letters means the differences is significant.
2.2 小鼠肝脏、脾脏载菌量检测结果
对2组小鼠肝、脾的细菌进行平板计数分析,结果发现在第1天肝、脾载菌量差异不显著(P>0.05);在第2~5天,注射LM-SB5的小鼠肝、脾载菌量要显著高于注射LM-Δhfq的小鼠肝、脾载菌量(P<0.05),第3天差异极显著(P<0.01)(图1);表明LM-Δhfq在宿主体内生存增殖能力弱于LM-SB5,即hfq基因能够在一定程度上影响LM在宿主体内的生存增殖。
2.3 小鼠肝、脾、肾病理变化
与正常的小鼠肝、脾、肾(图2-A~C)形态相比,LM-SB5及LM-Δhfq均可引起小鼠肝、脾、肾产生一定的病理变化,LM-SB5感染的肝脏切片有明显的坏死灶,内有蓝染坏死的肝细胞、巨噬细胞以及淋巴细胞,有的只留下细胞轮廓,肝细胞溶解坏死,组织结构消失,含有大量的组织碎片,出现网状丝状结构(图2-D);脾脏中脾小结体积增大,细胞间结构松散,有明显的坏死灶,淋巴小结部位淋巴细胞坏死,淋巴组织出血(图2-E);肾脏中肾小球肿胀,肾小球内细胞增多充血、出血,肾小管上皮细胞发生颗粒变性、坏死,部分肾小管间质有大量的红细胞(图2-F)。LM-Δhfq感染的肝脏切片有的区域轻微肝淤血,肝索排列疏松,同样有炎性细胞及坏死的肝脏细胞(图2-G);脾脏中有明显的坏死灶,淋巴小结部位淋巴细胞坏死,淋巴组织出血(图2-H);肾脏有明显的颗粒样变性,肾小球充血、出血(图2-I)。表明hfq基因缺失后LM对小鼠组织器官的损伤能力也有所减弱。
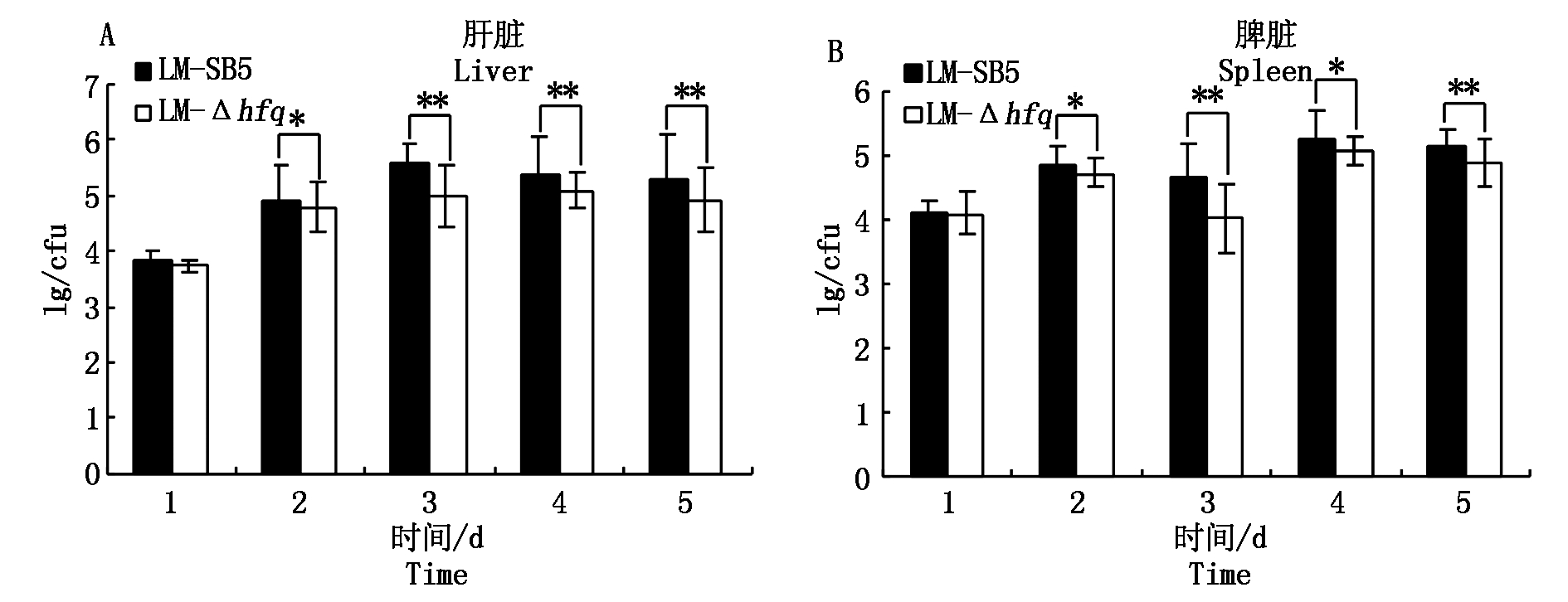
A.肝脏细菌计数结果;B.脾脏细菌计数结果;*.差异显著;**.差异极显著。图4同。
A.Bacterial count in the livers;B.Bacterial count in the spleens;*.The differences is significant;**.
The differnces is extremely significant.The same as Tab.4.
图1 腹腔注射LM-SB5与LM-Δhfq小鼠肝、脾细菌计数结果
Fig.1 Bacterial count of LM-SB5 and LM-Δhfq in the livers and spleens of mice infected by intraperitoneal infection
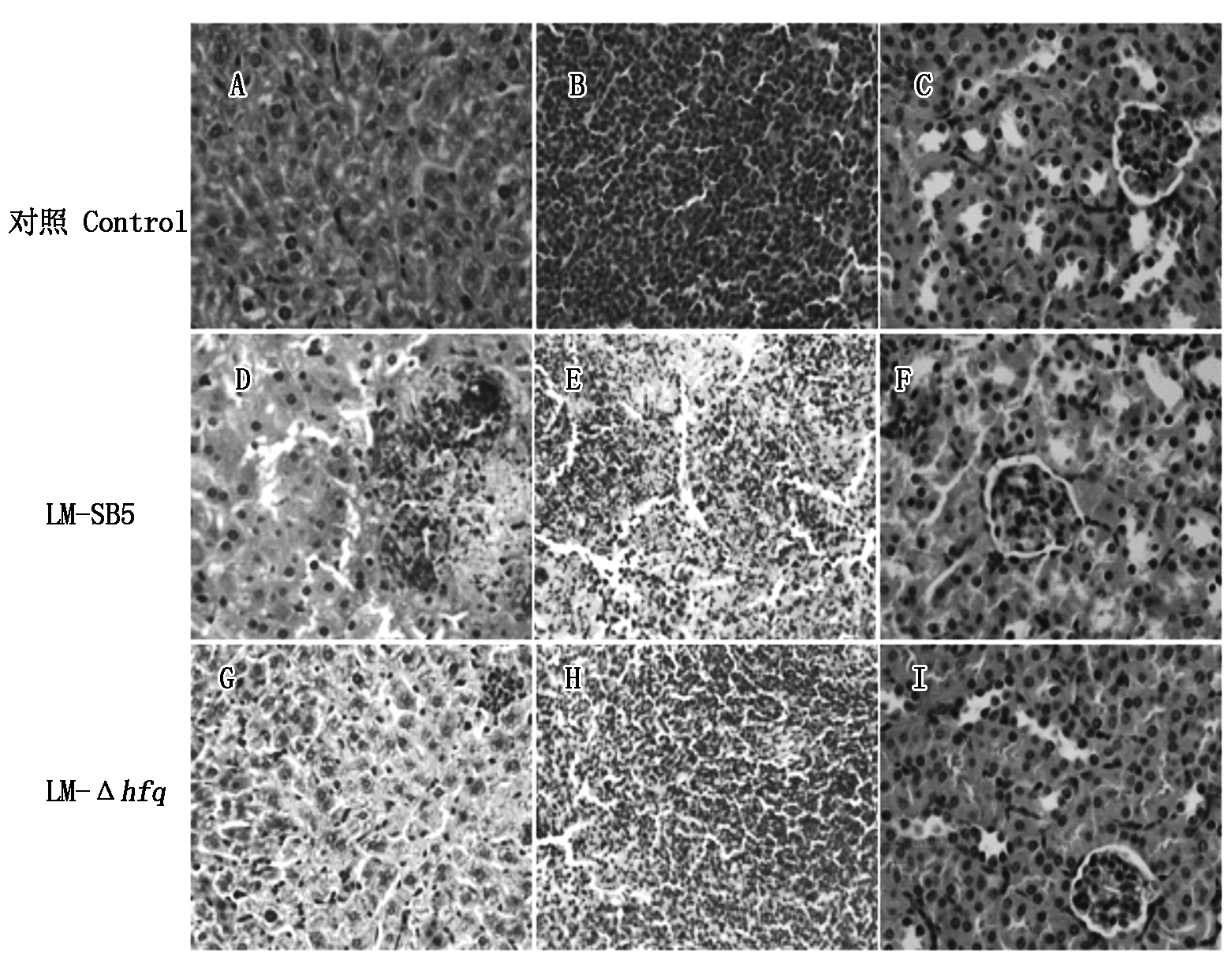
A~C.正常肝、脾、肾;D~F.腹腔注射LM-SB5肝、脾、肾病理变化;G~I.腹腔注射LM-Δhfq肝、脾、肾病理变化。
A-C.The histopathological slices of the normal liver,spleen,and kidney;D-F.Histopathological changes in the liver, the spleen, and the kidney of mice injected with LM-SB5;G-I.Histopathological changes in the liver,the spleen,and the kidney of mice injected with LM-Δhfq.
图2 腹腔注射LM-SB5与LM-Δhfq后组织病理学变化(HE×400)
Fig.2 Histopathological changes of mice after intraperitoneal injection of LM-SB5 and LM-Δhfq(HE×400)
2.4 溶血活性检测结果
通过溶血试验检测LM-SB5及LM-Δhfq溶血活性,结果发现LM-SB5的溶血效价为2-3,LM-Δhfq的溶血效价为2-2,其溶血能力下降了2倍。表明hfq基因对LM溶血能力具有一定的调节能力(图3)。

图3 LM-SB5 与 LM-Δhfq溶血活性测定
Fig.3 Hemolysis activity assay of LM-SB5 and LM-Δhfq
2.5 hfq基因缺失对生物被膜生成能力的影响
在24 h时,LM-SB5和LM-Δhfq生物被膜生成能力差异显著(P<0.05),LM-Δhfq生物被膜生成能力显著低于LM-SB5(图4);而在48 h时二者的生物被膜生成能力差异不显著(P>0.05)。倒置显微镜观察在24,48 h时LM-SB5与LM-Δhfq都生成了典型的生物被膜形态,在24 h LM-Δhfq生物被膜厚度明显低于LM-SB5(图5)。
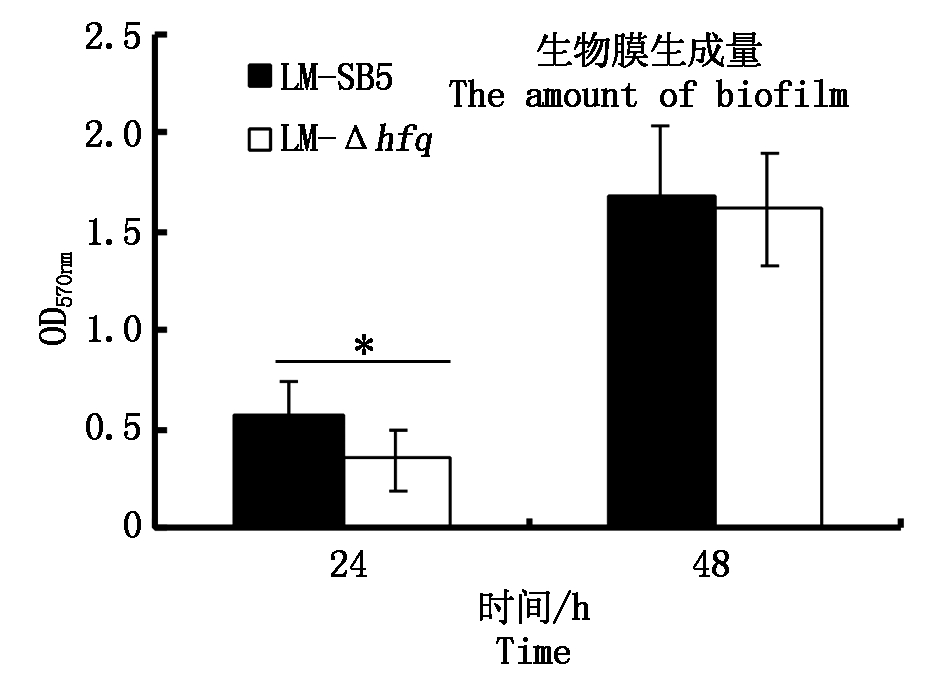
图4 生物被膜OD570检测结果
Fig.4 Biofilm determined by OD570
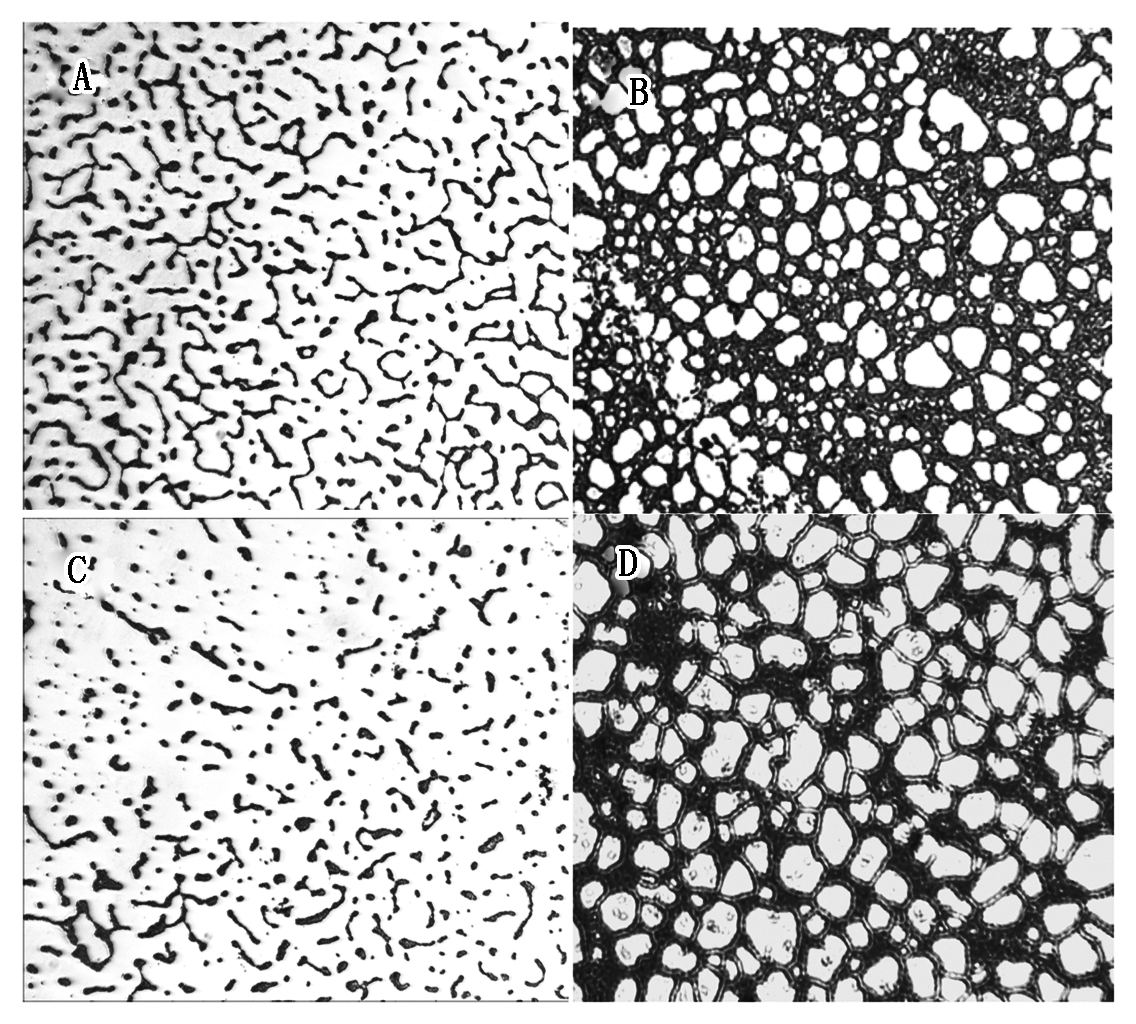
A与B.LM-SB5分别在24,48 h形成的生物被膜;
C与D.LM-Δhfq分别在24,48 h形成的生物被膜。
A and B.Formation of biofilm by LM-SB5 at 24,48 h;
C and D.Formation of biofilm by LM-Δhfq at 24,48 h.
图5 LM-SB5与LM-Δhfq形成的生物被膜
Fig.5 Formation of biofilm by LM-SB5 and LM-Δhfq
3 讨论
LM作为WHO规定的四大食源性致病菌之一,通过污染饮水、食品、饲草料而引起人与动物食物中毒,对人类健康构成了极大威胁,也给畜牧业发展带来较大的经济损失,严重威胁公共卫生安全。此外,LM还能够产生生物被膜,生物被膜是细菌通过分泌胞外基质粘附于生物或非生物表面形成具有一定立体结构的微生物聚集群体,形成生物被膜的菌体在胞外基质的保护下能够阻止减缓抗菌药物及杀菌物质的渗透,从而使细菌有足够的时间调控相关基因的表达,以调节其对胁迫环境的应激能力及动物机体致病力。由于产生生物被膜的细菌对抗菌药物更不敏感,在临床上通常会导致一些疾病呈现持续性感染发作[9]。
随着生物信息学发展以及对微生物基因组整体水平研究不断深入,LM成为研究革兰氏阳性菌Hfq蛋白以及ncRNA的模式细菌。Hfq是一种热稳定蛋白调控因子,其分子量大小和功能在不同细菌中有所不同[10-12]。对革兰氏阴性菌Hfq蛋白结构和功能的研究比较深入,并已证实该蛋白是一种重要的环境应激和毒力调控因子,然而对革兰氏阳性菌Hfq蛋白研究相对较少,其主要作为ncRNA的分子伴侣发挥作用。ncRNA按照作用机制可以分为反义RNA(anti-sense RNA,asRNA),顺式作用RNA(Cis-acting RNA)和反式编码小RNA(Trans-encoded small RNA,sRNA),在革兰氏阴性菌中Hfq蛋白作为大部分sRNA的分子伴侣发挥作用,能够通过影响sRNA与目的mRNA的结合,进而影响基因的表达。而在革兰氏阳性菌中只有少量sRNA与Hfq蛋白发生互作,在LM中已经发现的200多种sRNA,通过免疫共沉淀鉴定只得到3种sRNA可以与Hfq蛋白发生互作。众多的研究表明,Hfq蛋白在不同细菌中具有不同的作用,在同种细菌中参与不同sRNA调控细菌基因表达过程中的作用方式也有所区别[13-16]。
Christiansen等[17]研究表明,Hfq蛋白参与了LM对高渗及乙醇环境压力的应激过程和对小鼠的致病性。本研究通过动物感染试验证实hfq基因缺失引起LM对小鼠的毒力、肝脾中的生存增殖能力、溶血能力显著减弱,表明hfq基因缺失能够导致LM毒力相关生物学特性的降低。同时通过结晶紫染色的方法制备了生物被膜,结果显示在24 h时生物被膜的生成量显著降低,而在48 h时生物被膜的生成量没有显著差异。Huang等[18]通过插入失活的方式发现gltB、gltC基因的缺失是引起LM生成量显著降低的主要原因。Peng 等[19]进一步研究发现在缺失sRNA rli60基因时,LM的生物被膜生成量显著降低,且rli60基因缺失引起生物被膜生成相关基因gltB、gltC的表达量显著下降。Zhou等[20]研究发现PrfA基因缺失引起LM生物被膜生成能力显著降低。表明生物被膜的生成能力受到自身众多基因的调控作用。目前的研究发现与生物被膜生成相关的因素众多:外在因素包括附着面的理化性质、温度、培养基pH、金属离子等,内在因素主要包括众多基因表达的开启及关闭[9,20]。通过缺失hfq基因LM生物被膜的生成量显著降低,表明LM生物被膜的生成在一定程度上直接或间接受到hfq基因表达的影响。但是生成生物被膜的细菌只是具有了对外界胁迫环境更强的适应能力而存活下来,进而具备了感染宿主的先决条件。而处于生物被膜状态下的细菌突破机体免疫系统的能力及致病能力是否得到相同程度的提高,即本研究中hfq基因缺失引起LM毒力及生物被膜生成能力的同时降低,这二者之间是否具有对应的因果关系还有待于进一步研究。总之,本研究表明hfq基因缺失对LM的毒力及生物被膜生成具有一定的调节作用,为进一步开展针对Hfq蛋白调控机理的研究奠定了理论基础。
[1] 陆承平.兽医微生物学[M].北京:中国农业出版社,2010.
[2] Good J A,Andersson C,Hansen S,et al.Attenuating listeria monocytogenes virulence by targeting the regulatory protein PrfA[J].Cell Chemical Biology,2016,23(3):404-414.
[3] Kakoschke T,Kakoschke S,Magistro G,et al.The RNA chaperone Hfq impacts growth,metabolism and production of virulence factors in Yersinia enterocolitica[J].PLoS One,2014,9(1):e86113.
[4] Someya T,Baba S,Fujimoto M,et al.Crystal structure of Hfq from Bacillus subtilis in complex with SELEX-derived RNA aptamer:insight into RNA-binding properties of bacterial Hfq[J].Nucleic Acids Research,2012,40(4):1856-1867.
[5] Pandey S P,Winkler J A,Li H,et al.Central role for RNase YbeY in Hfq-dependent and Hfq-independent small-RNA regulation in bacteria[J].BMC Genomics,2014,15(1):121.
[6] Meng X,Meng X,Zhu C,et al.The RNA chaperone Hfq regulates expression of fimbrial-related genes and virulence of Salmonella enterica serovar Enteritidis[J].FEMS Microbiology Letters,2013,346(2):90-96.
[7] Mellin J R,Cossart P.The non-coding RNA world of the bacterial pathogen Listeria monocytogenes[J].RNA Biology,2012,9(4):372-378.
[8] Sievers S, Lund A, Menendez-Gil P, et al. The multicopy sRNA LhrC controls expression of the oligopeptide-binding protein OppA in Listeria monocytogenes[J]. RNA Biol, 2015, 12(9):985-997.
[9] Teschler J K,Zamorano-Sánchez D,Utada A S,et al.Living in the matrix:assembly and control of Vibrio cholerae biofilms[J].Nature Reviews Microbiology,2015,13(5):255-268.
[10] Sauer E.Structure and RNA-binding properties of the bacterial LSm protein Hfq[J].RNA Biology,2013,10(4):610-618.
[11] Mura C,Randolph P S,Patterson J,et al.Archaeal and eukaryotic homologs of Hfq:A structural and evolutionary perspective on Sm function[J].RNA Biology,2013,10(4):636-651.
[12] Yonekura K,Watanabe M,Kageyama Y,et al.Post-transcriptional regulator Hfq binds catalase HPII:crystal structure of the complex[J].PLoS One,2013,8(11):e78216.
[13] Régnier P,Hajnsdorf E.The interplay of Hfq,poly(A) polymerase Ⅰ and exoribonucleases at the 3′ ends of RNAs resulting from Rho-independent termination:A tentative model[J].RNA Biology,2013,10(4):602-609.
[14] Wilusz C J,Wilusz J.Lsm proteins and Hfq:Life at the 3 end[J].RNA Biology,2013,10(4):592-601.
[15] Nielsen J S,Larsen M H,Lilleb k E M,et al.A small RNA controls expression of the chitinase ChiA in Listeria monocytogenes[J].PLoS One,2011,6(4):e19019.
k E M,et al.A small RNA controls expression of the chitinase ChiA in Listeria monocytogenes[J].PLoS One,2011,6(4):e19019.
[16] Sievers S,Sternkopf Lilleb k E M,Jacobsen K,et al.A multicopy sRNA of Listeria monocytogenes regulates expression of the virulence adhesin LapB[J].Nucleic Acids Research,2014,42(14):9383-9398.
k E M,Jacobsen K,et al.A multicopy sRNA of Listeria monocytogenes regulates expression of the virulence adhesin LapB[J].Nucleic Acids Research,2014,42(14):9383-9398.
[17] Christiansen J K,Larsen M H,Ingmer H,et al.The RNA-binding protein Hfq of Listeria monocytogenes:role in stress tolerance and virulence[J].Journal of Bacteriology,2004,186(11):3355-3362.
[18] Huang Y,Suo Y,Shi C,et al.Mutations in gltB and gltC reduce oxidative stress tolerance and biofilm formation in Listeria monocytogenes 4b G[J].International Journal of Food Microbiology,2013,163(2/3):223-230.
[19] Peng Y L,Meng Q L,Qiao J,et al.The regulatory roles of ncRNA Rli60 in adaptability of listeria monocytogenes to environmental stress and biofilm formation[J].Current Microbiology,2016,73(1):77-83.
[20] Zhou Q,Feng F,Wang L,et al.Virulence regulator PrfA is essential for biofilm formation in Listeria monocytogenes but not in Listeria innocua[J].Current Microbiology,2011,63(2):186-192.