猪白细胞抗原 (Swine lymphocyte antigen,SLA)Ⅱ类基因簇是 SLA 三类基因中跨度最小(0.5 Mb)的基因分子,定位于7q1.1长臂,其主要功能是通过抗原呈递细胞(APC)将外源性抗原呈递给 CD4+辅助 T 细胞受体,导致 TCR 激活和分化,从而在清除外来抗原和诱发免疫应答过程中起重要作用,SLA Ⅱ类基因对动物的抗病性和生产性能方面具有广泛的影响[1-2]。SLA Ⅱ类区域编码多种多样的基因,包括-DR、-DQ、-DM和-DO蛋白的 α 链和 β 链基因,其中仅有 -DR 和 -DQ 基因能在蛋白质水平上表达[3]。DRA 基因位于Ⅱ类抗原 α 链,由 4 个外显子组成,外显子 1 编码前导序列,外显子2、3 分别编码 α1 和 α2 功能区,外显子 4 编码跨膜区和胞浆区,DRA 基因属于低度多态,具有一定的保守性[4]。
目前,关于猪 DRA 基因的报道主要集中在不同猪种 DRA 基因外显子多态性及其与生产性状和疾病抗性等方面的研究[5-9],而有关 DRA 基因蛋白质结构的研究仅见于长白猪、藏猪、合作猪、湖南大围子猪、沙子岭猪、八眉猪、巴马小型猪[10-15],尚未有关于烟台黑猪 DRA 基因蛋白质结构特性的报道。莫斯科等[11]对甘肃藏猪 DRA 和 DRB 基因的同源性对比显示了合作猪在猪-人异种移植中的应用潜力。唐医亚等[12]和王燕等[13]通过对湖南沙子岭猪和湖南大围子猪 SLA-DR 基因克隆,认为2个品种猪 SLA-DR 基因与人 HLA-DR 基因间具有较高的同源性。刘丽霞等[14]对八眉猪 DRA 基因编码区进行蛋白质结构预测发现 DRA 基因编码一种不稳定的不可溶蛋白。姜平等[15]对荷包猪 DRA-HB 全基因编码区进行克隆测序并分析了其分子进化关系后,发现其变异区集中在135,159,202位点。
烟台黑猪原产地为胶东地区,是以当地灰皮黑猪为基础,选育而成的一种优良地方猪种,具有抗逆性强、产仔率高、耐粗饲、生长发育快、肉品质好等特点[16],因此,本研究以甘肃红古区引入的烟台黑猪为研究对象,采用 PCR-SSCP、克隆测序和生物信息学等方法研究 SLA-DRA基因编码区(Coding region,CDS)多态性、氨基酸理化性质、结构域特征,并对蛋白质的结构和功能进行预测和分析,以期明确烟台黑猪 SLA-DRA基因的遗传特征,为该基因作为某些经济性状和抗病候选基因等遗传育种研究提供一定的理论依据。
1 材料和方法
1.1 试验材料
290 头烟台黑猪来自甘肃省红古区黑猪饲养场。采集耳组织样品,-20 ℃ 保存,常规酚/氯仿抽提法提取基因组 DNA,经琼脂糖凝胶电泳和紫外分光光度法检测 DNA 的纯度和浓度,检测合格后,-20 ℃ 保存备用。
1.2 引物设计和PCR扩增
参照 GenBank 中太湖猪 SLA-DRA基因序列(登录号:AY303990),采用 Primer 5.0 软件设计 SLA-DRA基因4个外显子的扩增引物(表 1),由大连宝生物公司合成。
PCR 扩增采用 25 μL 的反应体系:10×Buffer 缓冲液 2.5 μL,dNTP 1 μL(2.5 mmol/μL),上下游引物各0.5 μL(10 pmol/μL),Taq DNA聚合酶 0.5 μL(5 U/μL),模板 DNA 1 μL(50~100 ng/μL),灭菌 ddH2O 19 μL。PCR 扩增条件;预变性 94 ℃ 3 min;变性 94 ℃ 30 s,退火温度详见表 1,延伸 72 ℃ 30 s,35 个循环;最后延伸 72 ℃ 10 min,4 ℃ 保存,PCR 产物用 2% 的琼脂糖凝胶电泳检测。
1.3 PCR 扩增产物的 SSCP 检测
分别取 3 μL SLA-DRA基因 PCR 产物,加入 7 μL 变性剂(98% 去离子甲酰胺、0.025% 溴酚蓝、0.025% 二甲苯青、10 mmol/L EDTA(pH值0.8)),经 98 ℃ 变性 10 min,迅速冰浴 10 min,上样于充分预冷的非变性聚丙烯酰胺凝胶,4 ℃ 条件下进行电泳,电泳条件参见表 1,电泳结束后银染法显色。
表1 SLA-DRA基因外显子的引物序列和SSCP反应条件
Tab.1 Primer and SSCP condition of SLA-DRA gene exons

基因位置Gene location序列(5'-3')Primer预计/实际片段长度/bpExpected / Practicalfragment退火温度/℃AnnealingtemperatureSSCP条件SSCP condition外显子1 exon 1F: CTTTGCTTGTATTGC186/7656.812%(Acr∶Bis=39∶1), (151-226)R: ACCTAACTACCCCTC250 V,0.5 h, 200 V,20 h外显子2 exon 2F: TGCTAAACAGGGAAGGCT257/24656.610%(Acr∶Bis=29∶1),(2 884-3 129)R: ACAAAGGAGACTGAGG-GATG250 V,0.5 h, 200 V,20 h外显子3 exon 3F: TGCTAAACAGGGAAGGCT352/28256.810%(Acr∶Bis=39∶1),(3 573-3 854)R: ACAAAGGAGACTGAGG-GATG250 V,0.5 h, 200 V,20 h显子4 exon 4F: TCCCGTAATACATCGTTC357/15555.610%(Acr∶Bis=29∶1),(4 155-4 309)R: TTCCTTTCCTTGGCTCAT250 V,0.5 h, 200 V,16 h
注:Acr∶Bis.丙烯酰胺与N,N′-亚甲基双丙烯酸酰胺的比值。
Note: Acr∶Bis.The ratio of acrylamide and N,N′-methylenebisacrylamide.
1.4 克隆测序
根据显影后不同的 SSCP 条带模型,每种类型随机挑取 3 个不同的 PCR 产物,用琼脂糖凝胶 DNA 回收试剂盒回收纯化后,采用载体 pMD®19-T Vector 连接,构建重组质粒,并转化大肠杆菌(Escherichia coli)DH5α 菌株;挑选阳性克隆培养后,进行菌液 PCR 扩增;菌液 PCR 产物与初始 PCR 产物再次通过非变性聚丙烯酰胺凝胶电泳,显色后进行模型条带比较,进一步确定测序菌落的正确性,每一种基因型挑选 2 个克隆的菌液 PCR 产物送上海生物工程有限公司进行测序。
1.5 数据统计及生物信息学分析
利用PopGene 32 软件和 PIC 软件(Bostein)[17]计算基因的多态性信息,MEGA 6.0 软件进行 DNA 分析与比对,SLA-DRA 基因及其蛋白质的生物信息学分析过程如表 2 所示。
表2 蛋白质功能和结构预测相关网站
Tab.2 The websites and softwares of prediction of function and structure of protein
分类 Category网址和软件 Website and software单核苷酸多态性 SNPsNCBI dbSNP 数据库(http://www.ncbi.nlm.nih.gov/SNP/index.html)蛋白质的功能 Protein functionProtfun 在线软件(http://www.cbs.dtu.dk/services/ProtFun )开放阅读框 Open read frameNCBI ORF在线软件(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)疏水性分析 Hydrophobicity analysisProtscale(http://web.expasy.org/protscale/)磷酸化位点 Phosphorylation siteNetPhos (http://www.cbs.dtu.dk/services/NetPhos)糖基化位点 Glycosylation siteNetNGlyc (http://www.cbs.dtu.dk/services/NetNGlyc)信号肽位置 Signal peptideSignalIP (http://www.cbs.dtu.dk/services/SignalP/)结构域 Protein structural domainhttp://smart.embl-heidelberg.de/smart/set_mode.cgi?NORMAL=1二级结构 Secondary structureNPS 软件(http://npsa-pbil.ibcp.fr/)同源模型 Tertiary structureExPasy的SWISS-MODEL(http://us.expasy.org/)合理性分析 Homologous model analysisDeepView 软件系统发育树 Molecular evolutionary treeMEGA 6.0 软件
2 结果与分析
2.1 SLA-DRA基因核苷酸序列多态性分析
2.1.1 PCR 扩增及 SSCP 检测 SLA-DRA基因外显子的PCR扩增产物经 2% 的琼脂糖凝胶电泳检测,目的条带清晰且无非特异扩增者,判断其扩增产物为目的条带,再进行后续试验分析。经 SSCP 检测,exon 1 检测到 2 种等位基因(A 和 B),共形成 3 种基因型(AA、BB 和 AB,图 1-A);exon 2 检测到 3 种等位基因(A、B 和 C),共形成 4 种基因型(AA、BB、AB 和 AC,图 1-B);exon 3 仅检测到 1 种等位基因 A,形成1种基因型 AA(图 1-C),exon 4 检测到 5 种等位基因(A、B、C、D和 E),共形成 8 种基因型(AA、BB、AB、CC、BC、AC、DD和 AE,图 1-D)。

每种带型代表1种基因型。
Every pattern represents one genotype.
图1 SLA-DRA基因外显子 PCR-SSCP 检测
Fig.1 The SSCP analysis of the SLA-DRA gene exons
2.1.2 SLA-DRA基因外显子序列比对分析 将克隆测序得到的序列去除引物序列及内含子序列,得到有效的外显子序列,将4个外显子的等位基因序列利用 dbSNP 进行比对,发现 exon 1、2、4 分别检测到 2,2 ,7个SNPs(表 3),共导致 7 个氨基酸发生错义突变,exon 1 等位基因 A含有 2个SNPs(c.178A>G和c.179G>A),导致1个氨基酸发生变异 p.10Gly>Arg;exon 2 等位基因 C包含2个 SNP 位点,其中包括1个新的SNP位点c.3104C>T,该位点没有引起氨基酸的变异;exon 4 共检测到7个SNPs,多态性最为丰富,导致5个氨基酸发生变异(p.206Gln>Asn、p.212Thr>Asn、p.216Thr>Pro、p.219Ala>Ser 和 p.248Arg>His),属于错义突变,详见表 3。各外显子等位基因序列提交至 GenBank,登录号见表 4。
表3 烟台黑猪SLA-DRA基因CDS区突变位点
Tab.3 The mutations sites of SLA-DRA gene CDS region in Yantai black pig

突变区域Mutation regions核苷酸突变位点Mutation sites of nucleotides氨基酸突变位点Mutation sites of amino acids外显子 1 exon 1c.178A>G、c.179G>Ap.10Gly>Arg外显子 2 exon 2c.3093A>C、c.3104C>Tp.96Met>Leu外显子 4 exon 4c.4167A>G、c.4185C>A、c.4196A>C、p.206Gln>Asn、p.212Thr>Asn、 c.4205G>T、 c.4208C>T、c.4246A>G、p.216Thr>Pro、p.219Ala>Ser、c.4293G>Ap.248Arg>His
注:加下划线表明新突变位点。
Note:The underline represent the new mutation site.
表4 猪 SLA-DRA基因等位基因和基因型的频率、遗传参数及 GenBank 基因序列登录号
Tab.4 The allelic and genotypic frequencies,population genetic parameters of SLA-DRA gene and the accession numbers in GenBank database

位 置Locus等位基因 Allele登录号Accession No.频 率Frequencies基因型 Genotype频 率Frequencies外显子1A已知 KR0239980.55AA0.42 (123)exon 1B已知 KR0239990.45BB0.32 (92)AB0.26 (75)外显子2A已知 KM4119760.70AA0.47 (134)exon 2B已知 KM4119750.22BB0.07 (20)C新发现KM4119780.08AB0.30 (88)AC0.16 (48)外显子4A已知 KM4855530.41AA0.23 (66)exon 4B已知 KM4855540.34BB0.27 (80)C已知 KM4877050.20AB0.04 (12)D已知 KM4877060.01CC0.04 (12)E已知 KM4855530.04AC0.25 (72)BC0.08 (22)DD0.01 (4)AE0.08 (22)
2.2 SLA-DRA基因CDS区蛋白质的功能和结构预测
2.2.1 SLA-DRA基因开放阅读框(Open reading frame,ORF)的分析 根据 NCBI 数据库 ORF Find 在线软件预测烟台黑猪 SLA-DRA 基因编码区开放阅读框,由图 2 所示,一共预测出6个开放阅读框,其中第 1~758 bp 为最长、最完整的 SLA-DRA 基因开放阅读框。

图2 SLA-DRA 基因开放阅读框预测
Fig.2 The open reading frame prediction of SLA-DRA gene sequence
2.2.2 SLA-DRA基因氨基酸序列理化性质分析 猪 SLA-DRA基因编码区核苷酸序列全长为 759 bp,共编码 252 个氨基酸和 1 个终止子,其中有 7 个氨基酸发生变异,分布在 exon 1、2、4 区域。SLA-DRA基因与参考序列AY303990的 CDS 氨基酸对比见图 3。SLA-DRA基因的氨基酸分子式为C2267H3777N759O941S208,分子量为 7 952,等电点(pI)理论值为 5.08,偏弱酸性。脂肪系数为 23.58,半衰期为 4.4 h,不稳定系数为 50.11(<40 为稳定蛋白),属于不稳定蛋白质。蛋白质功能位点预测结果显示:SLA-DRA基因氨基酸链包括2个N-糖基化位点(第141~143,244~246位)和 10 个磷酸化位点(第36,38,42,64,116,166,179,184,207,213位)。

波浪下划线为N-糖基化位点;加粗下划线为磷酸化位点;黑色方框为信号肽区域。
The wave underline represents N-glycosylation site;Bold underlined represents phosphorylation site;Black box is signal peptide.
图3 SLA-DRA基因与参考序列 AY303990 的 CDS 氨基酸序列比对
Fig.3 Amino acid sequences alignment of CDS between SLA-DRA gene and AY303990
2.2.3 SLA-DRA基因氨基酸序列的疏水性分析 对SLA-DRA基因氨基酸亲水性进行预测,发现 4 个亲水性密集区域(图 4):第 36~77 位、第 96~123 位、第 160~215 位和第 240~248 位,其中第 227 位的缬氨酸(Val)亲水性最强,第 102 位的天冬氨酸(Asn)疏水性最强,总平均疏水系数为 0.842,为亲水性蛋白质。
2.2.4 SLA-DRA基因蛋白质的结构域分析 对蛋白质结构域进行预测,结果发现 SLA-DRA基因存在1个信号肽区域(第1~23位)和2个免疫球蛋白结合域(Immunoglobulin domain),分别位于:第 125~196 位 IGc1 域和第 199~251 位 C1 恒定区。
2.2.5 SLA-DQA基因蛋白质高级结构的同源建模及合理性分析 SLA-DRA基因的二级结构包含 α螺旋 59个(23.32%),β 折叠25个(9.88%),无规则卷曲96个(37.94%)和延伸链 73个(28.85%)(图5)。以 SWISS-MODEL 数据库序列4fqx.1.D(2.60Å)为模板[18],构建 SLA-DRA基因蛋白质三维结构的同源模型,结果见图6,该模型为单链空间构型,包括第 25~204 位氨基酸,该模型与模板序列相似性为0.58%,序列一致性达到 85.86%。全球模型质量评估(GMQE)得分为 0.79 [19-20]。运用DeepView 软件拉氏构象图检测同源模型的合理性,结果发现三维模型包括180 个氨基酸,其中173个氨基酸残基(96.1%)的二面角落在允许的范围内,仅有 7 个氨基酸残基(3.9%)的二面角落在不允许范围内(图7),SLA-DRA基因三维模型的二面角(φ,ψ)构象能量最低且稳定,符合立体化学所允许的构象图。
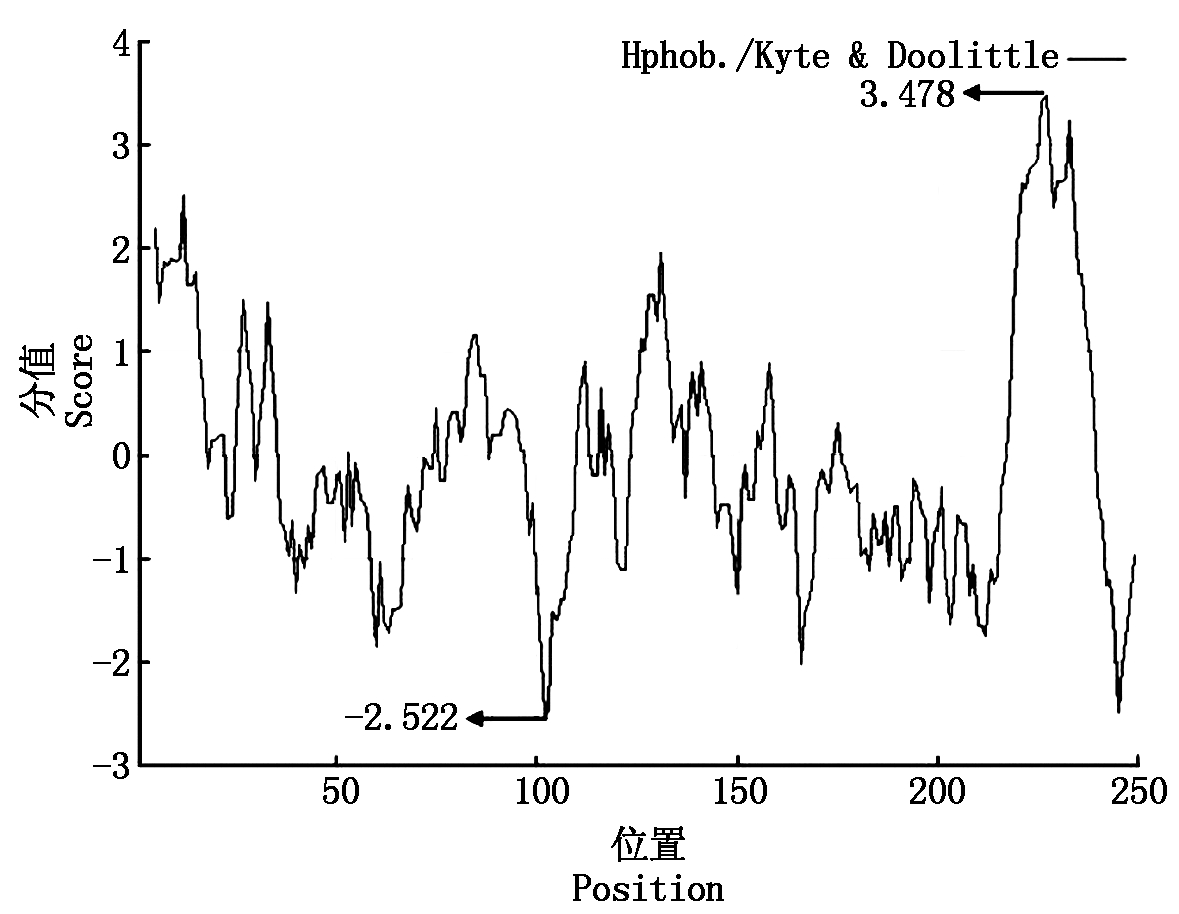
图4 SLA-DRA基因 CDS 蛋白质亲水性预测
Fig.4 The hydropathicity prediction of
SLA-DRA gene CDS protein

图5 SLA-DRA基因 CDS 蛋白质二级结构预测
Fig.5 Putative result of SLA-DRA gene CDS protein secondary structure
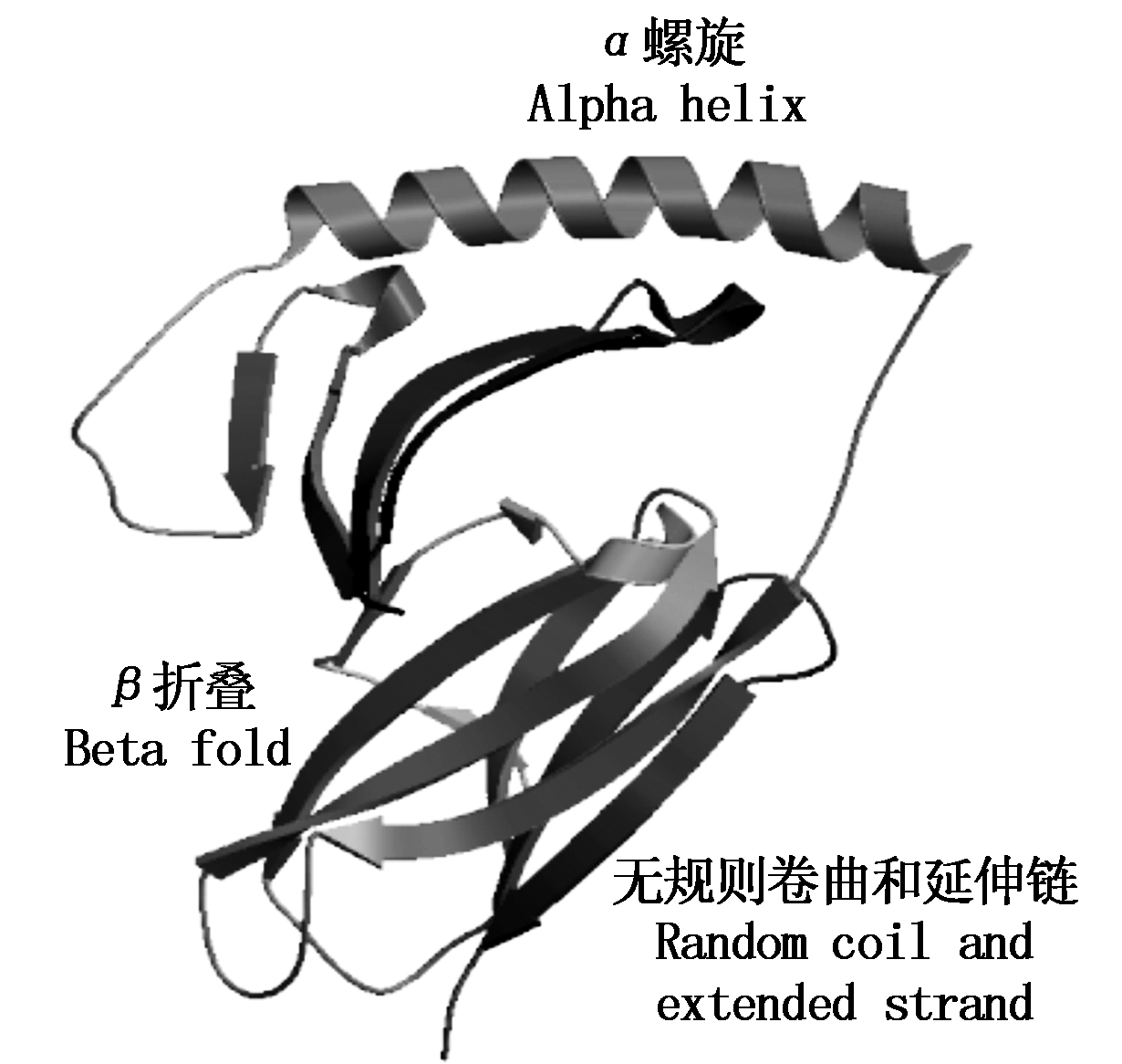
图6 猪SLA-DRA蛋白三级结构模型预测
Fig.6 Putative result of SLA-DRA
protein tertiary structure
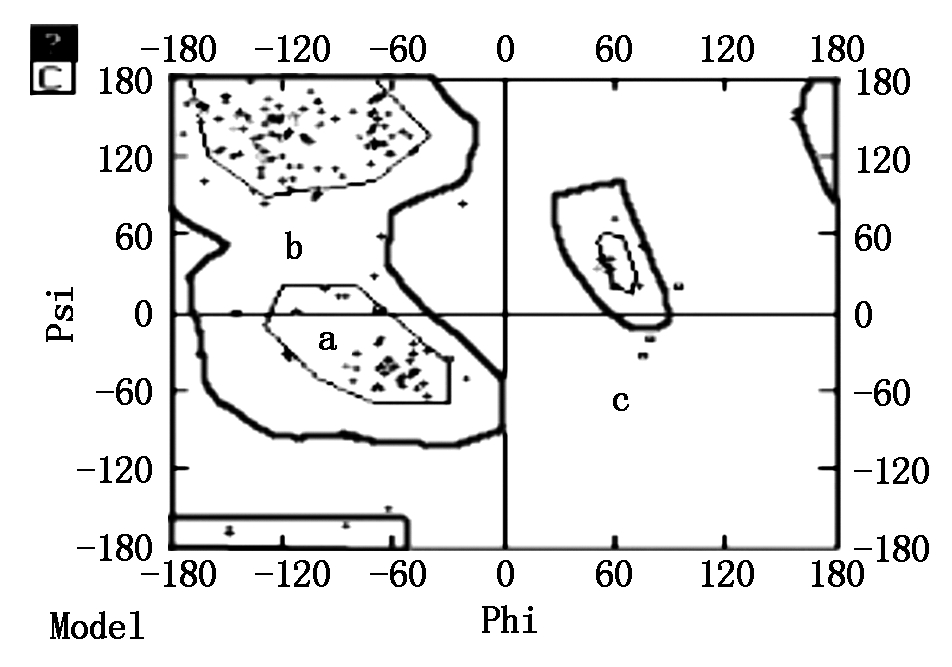
A.允许区;B.临界限制区;C.不允许区。
A.Appropriate area;B.Critical limits area;C.Inadmissibility area.
图7 SLA-DRA基因蛋白质三维模型的拉式构象图
Fig.7 Ramachandran Plot of 3D model of SLA-DRA gene
2.2.6 SLA-DRA基因 CDS 区蛋白质功能特性预测 对 SLA-DRA基因的蛋白质功能进行预测,结果见表 5。由表 5 数据可以看出,SLA-DRA基因的蛋白在信号转导、受体、胁迫应答、免疫应答和生长因子等方面的几率均较高。
表5 SLA-DRA基因编码蛋白质的功能预测
Tab.5 Putative result of protein function between SLA-DRA gene
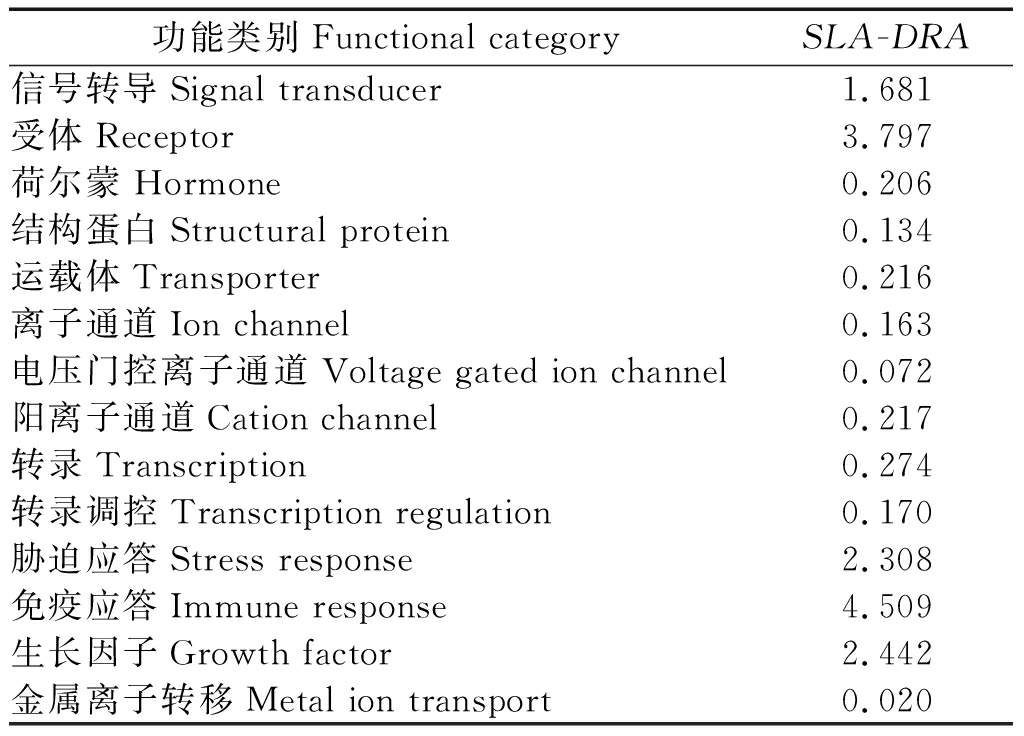
功能类别Functional categorySLA-DRA 信号转导Signal transducer1.681受体Receptor3.797荷尔蒙Hormone0.206结构蛋白Structural protein0.134运载体Transporter0.216离子通道Ion channel0.163电压门控离子通道Voltage gated ion channel0.072阳离子通道Cation channel0.217转录Transcription0.274转录调控Transcription regulation0.170胁迫应答Stress response2.308免疫应答Immune response4.509生长因子Growth factor2.442金属离子转移Metal ion transport0.020
2.3 SLA-DRA 基因分子进化树的构建
为了研究烟台黑猪 SLA-DRA 基因的分子进化关系,利用 Mega 6.0 构建该基因及 GenBank 中检索到的国内外共 28 个猪种 SLA-DRA 基因编码区序列的分子进化树。结果发现,烟台黑猪SLA-DRA基因与其他猪种DRA基因同源性高达 99.0% 以上,分子进化树如图8所示。从图8可以看出,烟台黑猪 SLA-DRA 基因与广西巴马小型猪及杂交猪在同一进化支,同时与大白猪也具有相对较近的亲缘关系。
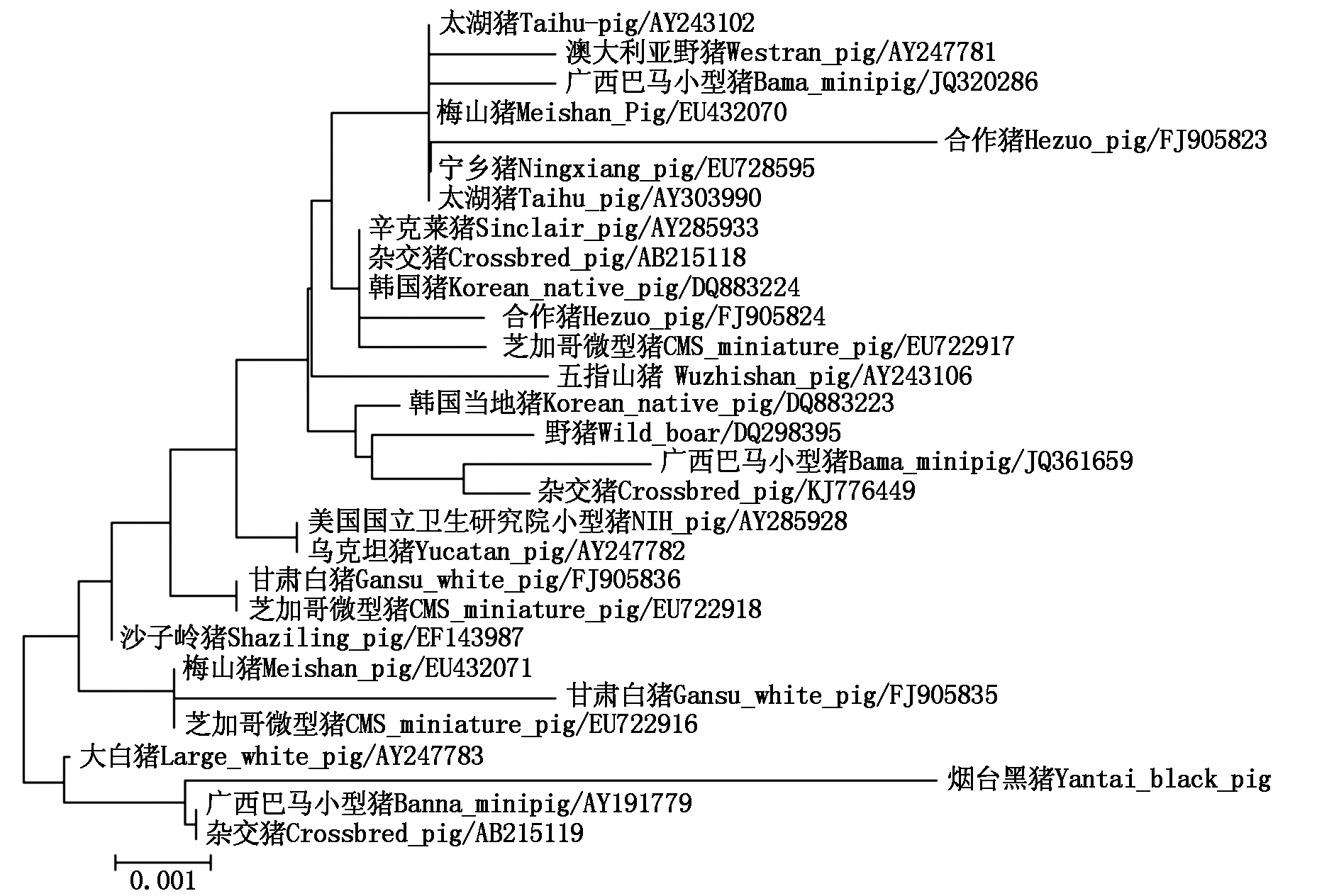
图8 烟台黑猪 SLA-DRA 基因系统发育树的构建
Fig.8 The phylogenetic tree construction of SLA-DRA gene in Yantai black pig
3 讨论与结论
猪 SLA 基因是猪基因组中最具多态性的基因之一,SLA Ⅱ 类抗原能够结合并呈递外源性抗原多肽到免疫细胞,进行免疫应答[1],SLA Ⅱ 类抗原的表达具有一种偏好性,与DQ抗原相比,DR抗原在 CD8+ T 细胞能够集中表达,在 CD4+ T 细胞中少量表达[11],而DR和DQ抗原可表达于 B 淋巴细胞和巨噬细胞表面,说明 DRA 基因的多态性与抗病能力具有非常重要关系,具有高度多态性的个体对环境和外界抗原的适应性能力比低度多态的个体更有优势。
目前 MHC 免疫多态性数据库(IPD-MHC:http://www.ebi.ac.uk/ipd/mhc/sla/)已收录了 169 条 SLA Ⅱ 类等位基因,包括 82 DRB1、44 DQB1、20 DQA 和 13 DRA。DRA 基因属于等位基因最少、多态性最低、相对保守的基因,有研究显示DRA 基因与人 DRA 基因序列同源性更高,且具有较一致的氨基酸长度[21],对 DRA 基因的深入研究能够为进一步揭示 DRA 基因的遗传特征、免疫机制,并为异种移植的免疫排斥反应提供有价值的理论依据。
本研究在烟台黑猪 DRA 基因 CDS 区共检测到11个SNPs,共导致 7 个氨基酸发生变异,这些突变位点与大白猪、长白猪、杜洛克、八眉猪、蕨麻猪和甘肃黑猪 DRA 基因的突变一致[7,14,22],进一步证明了 DRA 基因具有较低的多态性。在 DRA 基因4个外显子中,exon 4 的变异位点最多,多态性最为丰富,在其所形成的 8个基因型中,等位基因E只以杂合子形式存在,该种现象可能与近郊繁殖有关,仍需进一步研究确定。exon 4 主要编码跨膜区和胞浆区,能够通过该片段的疏水性区域插入细胞膜中,调节细胞膜的融合功能,其序列多态性的增加有利于细胞膜的跨膜运输与信号转导,诱发机体更强的免疫反应,在抗原的识别与递呈、免疫应答与调控等方面产生影响[23]。
SLA-DRA基因 CDS 区全长为 759 bp,是完整的开放阅读框区域,共编码 252 个氨基酸和 1 个终止子,氨基酸的理化性质分析显示,SLA-DRA基因蛋白质是一种偏酸性,不稳定,亲水性蛋白质,与吴雪斌[10]对长白猪的预测结果一致。烟台黑猪的等电点值为 5.08,较之于八眉猪的等电点值 5.12偏低[14]。半衰期远低于八眉猪的 30 h,贾浩等[24]认为蛋白质半衰期与其稳定性之间具有一定的正相关性,半衰期越长则蛋白质越稳定,说明烟台黑猪 SLA-DRA基因蛋白质稳定性比八眉猪的低,这种现象可能与蛋白质的结构和生理功能相关,有待进一步研究。
糖基化是最重要的翻译后修饰之一,能够调控蛋白质在组织和细胞中的定位、功能和活性,是与蛋白质结构和功能的关系密切的蛋白质修饰手段,其位点的变异可能与疾病的发生有关[25],本研究预测到的氨基酸序列存在2个 N-糖基化修饰区:第 141~143位、244~246 位,在合作猪、荷包猪、大围子猪、沙子岭猪和八眉猪中均有报道,说明这2个糖基化位点序列高度保守,可能与其承担重要的生物学功能有关。蛋白质磷酸化能够改变激酶的活性和离子通道,调节蛋白质在信号转导的过程,改变基因的表达,影响细胞的生产和分化[26]。本研究在烟台黑猪中预测到 10 个磷酸化位点,涉及蛋白激酶C 和酪蛋白激酶等磷酸化作用,与刘丽霞等[14]预测的八眉猪SLA-DRA基因氨基酸链中含有11个潜在磷酸化位点基本一致。
烟台黑猪DRA蛋白质结构域分析结果显示,氨基酸序列第 1~23 位是信号肽区域,第 125~196 位形成了免疫球蛋白(IGc1)区,该段区域对应于 exon 3 序列,高度保守,因此,免疫球蛋白 C1 的高度特异性可能与 SLAⅡ 类基因分子 α2 功能区在免疫过程中的重要作用紧密相关。此外,本研究还发现第 199~251 位是免疫球蛋白的 C1 恒定区。有研究表明:Ig 和 Ig-like 主要分为 V 可变区、C1 恒定区和 C2 恒定区等[27],C1 恒定区专一性与 MHC Ⅰ和Ⅱ 类复合体和不同的 T 细胞受体等分子相互作用,参与免疫系统反应,C1 恒定区还认为与抗体的效应功能相关,能够激活补体,结合细胞表面的 Fc 受体,能够介导抗体、补体与吞噬细胞表面结合的调理作用及超敏反应等过程[28]。
与其他猪种 SLA-DRA基因蛋白质的结果相似,烟台黑猪 SLA-DRA基因蛋白质二级结构是含有α 螺旋(59 个)、β 折叠(25 个)、无规则卷曲(96 个)和延伸链(73 个)的混合模型,其三级结构是由 DRA 基因 exon 2、3 编码的第 25~204 位氨基酸组成的单链空间构型,是蛋白质行使生物功能的主要区域,这与 exon 2、3 编码 α 链功能区的作用紧密相关[4]。此外,SLA-DRA基因蛋白质的功能预测结果显示信号转导、受体、胁迫应答、免疫应答的几率均略高于八眉猪,生长因子与八眉猪的一致[14],说明 DRA 基因功能在不同品种猪间相对稳定,且可能对猪的抗原递呈、结合等免疫过程以及生产性能方面起到较高的调节作用。分子进化树研究发现,烟台黑猪 DRA 基因与其他猪种 DRA 基因同源性高达 99.0% 以上,在进化关系上与巴马小型猪和杂交猪亲缘关系较近,并且与大白猪隶属同一进化分支,该结果可为烟台黑猪进化起源研究提供理论依据。
烟台黑猪 SLA Ⅱ 类DRA基因 4 个外显子具有不同程度的多态性,外显子 4 多态性最为丰富,猪 SLA-DRA 基因多态性的差异与猪对疾病抵抗能力的强弱有关,SLA-DRA基因的蛋白质的二级结构都是亲水性、不稳定的混合蛋白,SLA-DRA基因可能对猪的抗原结合、呈递能力和生产力起到较高的调节能力,本研究结果可为猪 SLA-DRA 基因作为某些经济性状和抗病分子育种的候选基因和分子标记研究提供重要的参考。
[1] Piriou-Guzylack L, Salmon H. Membrane markers of the immune cells in swine: an update [J]. Veterinary Research, 2008,39(6):54.
[2] Stenfeldt C, Pacheco J M, Rodriguez L L, et al. Early events in the pathogenesis of foot and mouth disease in pigs:identification of oropharyngeal tonsils as sites of primary and sustained viral replication[J]. PLoS One, 2013, 9(9):1-15.
[3] Lunney J K, Ho C S, Wysocki M, et al. Molecular genetics of the swine major histocompatibility complex,the SLA complex [J]. Developmental and Comparative Immunology, 2009, 33(3):362-374.
[4] Hirsch F, Germana S, Gustafsson K, et al. Structure and expression of class II alpha genes in miniature swine [J]. The Journal of Immunology, 1992, 149(3):841-846.
[5] Liu L X, Zhao S G, Lu H N, et al. Association between polymorphisms of the swine MHC-DQA gene and diarrhoea in three Chinese native piglets [J]. International Journal of Immunogenet, 2015, 42(3):208-216.
[6] Huang X Y, Yang Q L, Yuan J H, et al. Polymorphism and haplotype analyses of swine leukocyte antigen DQA exons 2, 3, 4, and their associations with piglet diarrhea in Chinese native pig [J]. Genetics and Molecular Research, 2015, 14(3):10461-10472.
[7] Yang Q L, Zhao S G, Wang D W, et al. Association between genetic polymorphism in the swine leukocyte antigen-DRA gene and piglet diarrhea in three Chinese pig breeds [J]. Asian-Australasian Journal of Animal Science, 2014, 27(9): 1228-1235.
[8] Huang X Y, Yang Q L, Yuan J H, et al. Effect of genetic diversity in swine leukocyte antigen-DRA gene on Piglet diarrhea [J].Genes, 2016, 7(7):36.
[9] Yang Q L, Huang X Y, Zhao S G, et al. Effect of swine leukocyte antigen-DQA gene variation on diarrhea in Large White, Landrace, and Duroc piglets [J]. Animal Genetics, 2016, 47(6):691-697.
[10] 吴雪斌. 猪SLA-DRA、SLA-DRB基因的克隆及其在大肠杆菌中的融合表达[D]. 雅安:四川农业大学, 2008.
[11] 莫斯科, 房永祥, 冯海燕, 等. 甘肃合作猪白细胞抗原经典Ⅱ类分子DR基因克隆及生物信息学分析[J]. 畜牧兽医学报, 2009, 40(11):1662-1668.
[12] 唐医亚, 邢晓为, 薛立群, 等. 湖南沙子岭猪SLA-DR基因克隆及生物信息学分析 [J]. 遗传, 2007, 29(12):1491-1496.
[13] 王 燕, 邢晓为, 薛立群, 等. 湖南大围子猪SLA-DR基因克隆及其生物信息学分析[J]. 细胞与分子免疫学杂志, 2009, 25(9):770-773.
[14] 刘丽霞, 张 丽, 赵生国, 等. 八眉猪DRA基因编码区多态性及生物信息学分析 [J]. 华北农学报, 2015,30(2):1-8.
[15] 姜 平, 高凤山, 额尔敦木图, 等. 荷包猪SLA-DRa基因的克隆及序列分析[J]. 中国畜牧兽医, 2015,42(2):264-269.
[16] 许刚璞, 许瑜伟. 烟台黑猪的调查报告 [J]. 中国畜禽种业, 2011(6): 61-62.
[17] Bostein D, White R L, Skolnick M, et al. Construction of a genetic linkage map in man using restriction fragment length polymorphisms [J]. American Society of Human Genetics, 1980, 32(3): 314-331.
[18] Pos W. Crystal Structure of the HLA-DM-HLA-DR1 complex defines mechanisms for rapid peptide selection [J]. Cell, 2012, 151(7):1557-1568.
[19] Lee K H, Wucherpfennig K W, Wiley D C. Structure of a human insulin peptide HLA-DQ8 complex and susceptibility to type 1 diabetes [J]. Nature Immunology, 2001, 2(6):501-507.
[20] Biasini M, Bienert S, Waterhouse A, et al. SWISS-MODEL:modelling protein tertiary and quaternary structure using evolutionary information [J]. Nucleic Acids Research, 2014, 42:252-258.
[21] 谈永松.SLA DQ和DR基因的结构、功能、表达及分子生物学分型的研究 [D].南京:南京农业大学, 2003.
[22] 刘 榜, 杨金娥, 樊 斌, 等.一个新的猪SLA-DRA等位基因的分离与分析 [J].农业生物技术学报, 2004, 12(2):228-229.
[23] Reyes L M, Blosser R J, Smith R F, et al. Characterization of swine leucocyte antigen alleles in a crossbred pig to be used in xenotransplant studies [J]. Tissue Antigens,2014,84(5):484-488.
[24] 贾 浩, 张小白, 宋晓峰. 人类胞内蛋白半衰期与其亚细胞定位的相关性研究 [J]. 计算机与应用化学, 2011, 28(4): 411-414.
[25] Defaus S, Gupta P, Andreu D, et al. Mammalian protein glycosylation-structure versus function [J]. Analyst, 2014, 139(12):2944-2967.
[26] Beenstock J, Mooshayef N, Engelberg D. How do protein Kinases take a selfie (Autophosphorylate) [J]. Trends in Biochemical Sciences, 2016, 41(11):938-953.
[27] Archbold J K, Macdonald W A, Gras S. Natural micropolymorphism in human leukocyte antigens provides a basis for genetic control of antigen recognition [J]. The Journal of Experimental Medicine, 2009, 206(1):209-219.
[28] Radosevich M,Ono S J. Novel mechanisms of class Ⅱ major histocompatibility complex gene regulation [J].Immunologic Research,2003, 27(1):85-106.