类胰岛素生长因子-1(Insulin-like growth factor 1,IGF-1)是从动物血清中发现的一种具有调控动物机体生长、发育和代谢的一个重要因子,主要介导生长激素发挥促生长作用[1]。IGF-1 为动物体内多功能生长因子,具有促进细胞对葡萄糖和氨基酸摄取与利用,增加糖原、脂肪和蛋白等的合成,刺激细胞遗传物质的复制、细胞增殖分化、性腺分泌,促进产后动物泌乳以及新生动物的肠道发育[2-4]。IGF-1具有内分泌、旁分泌、自分泌特性,主要由肝脏合成分泌到血液中,依赖与IGFBPS家族基因的运载而提高IGF-1的半衰期,以及组织的偏向性而促进组织细胞的分化与增殖[5]。猪IGF-1基因位于体细胞的第5号染色体上,基因全长80 kb(含5个内含子和6个外显子),该基因具有高度的保守性,其成熟肽氨基酸序列与牛、人的相同,但与鼠有3~4个氨基酸相异[6-8]。研究表明,猪血浆中IGF-1 水平与体重及增重呈正相关,IGF-1基因可以作为影响动物生长发育的候选基因,该基因受到研究者的广泛关注[9-10]。藏猪为地方特色品种资源,耐粗饲、肉质优良、肌肉鲜红、鲜嫩多汁、富含肌内脂肪,因此成为人们所追求的新型生态食品,且藏猪能适应高寒的放牧气候和以放牧为主的低劣饲养条件,也是一种优良的试验用小型猪品种[11-12],这些优点使藏猪具有广阔的应用前景,但其生长速度缓慢,属选育程度极低的品种。IGF-1在调控藏猪生长发育、代谢上扮演了一个重要的角色,然而目前没有关于藏猪IGF-1原核表达的报道。本研究首次对藏猪IGF-1成熟肽基因进行克隆,构建IGF-1成熟肽基因融合表达载体pET-32α-IGF-1,并在大肠杆菌BL21(DE3)中进行初步表达,优化表达条件,获得IGF-1融合蛋白,为研究藏猪IGF-1成熟肽蛋白的生物学功能及在藏猪生长发育过程中的调节作用及功能提供参考。
1 材料和方法
1.1 藏猪肝脏、质粒及菌株
猪肝脏采自四川农业大学实验养殖场屠宰的健康成年藏猪;E.coli DH5α、E.coli BL21(DE)、质粒pMD19-T、表达质粒pET-32α 均为四川农业大学动物微生态研究中心保存。
1.2 酶和试剂
RNA抽提纯化试剂盒(动物组织)和PCR产物纯化试剂盒、DNA胶回收试剂盒、Ni-NTA SefinoseTMResin试剂盒(上海生工公司);T4 DNA连接酶、反转录试剂盒、QUuickCutTMEcoR Ⅰ和QUuickCutTM XhoⅠ(TaKaRa公司),2×Taq Master Mix(北京康为世纪公司);Rabbit anti-human IGF-1和HRP标记的Goat anti-rabbit IgG(武汉博士德公司)。
1.3 PCR引物
扩增藏猪IGF-I基因全长序列P1、P2引物[13],扩增IGF-1成熟肽系列引物P3:5′- CGGAATTCGGACCTGAGACCCTCTGTGG-3′,P4:5′- CCGCTCGAGCATTCTGTAGTTCTTGTTTC -3′(下划线分别为EcoR Ⅰ、Xho Ⅰ酶切位点,斜体部分为终止密码子序列),引物由成都擎科生物科技有限公司合成。
1.4 藏猪肝总RNA提取及cDNA合成
取新鲜的藏猪肝脏组织50 mg,用液氮反复研磨成粉末,转入1.5 mL EP管中,然后参照试剂盒说明书提取、纯化肝组织总RNA,1%琼脂糖电泳(AGE)检查。以总RNA提取液3 μL为模板,反转录合成cDNA(反应条件:37 ℃ 15 min,85 ℃ 5 min)。
1.5 pMD19-T-IGF-1质粒的构建与鉴定
以cDNA为模板,扩增IGF-1全基因(反应体系:cDNA 2 μL,10 pmol/μL P1、P2各1 μL,2×Taq PCR Master Mix 10 μL,ddH2O 6 μL;反应条件:95 ℃ 5 min;95 ℃ 50 s,57 ℃ 55 s,72 ℃ 60 s,30个循环;72 ℃ 10 min),预期产物612 bp。PCR产物纯化回收后与pMD19-T载体连接,再转化E.coli DH5α,阳性单菌落经PCR鉴定和测序鉴定,正确的克隆命名为pMD19-T-IGF-1。
1.6 藏猪IGF-1成熟肽基因扩增及重组表达载体pET-32α-IGF-1的构建
以pMD19T-IGF-1为模板,进行藏猪IGF-1成熟肽基因的扩增(反应体系:2 μL pMD19T-IGF-1,上下游引物(10 pmol/μL)各1 μL,10 μL 2×Taq Master Mix,6 μL ddH2O,反应条件同上),扩增产物经1% AGE纯化回收。将纯化回收的IGF-1成熟肽PCR产物和载体PET-32α用EcoR Ⅰ和Xho Ⅰ 37 ℃ 双酶切25 min (双酶切体系为IGF-1/ PET-32α 50 μL,10×酶切Buffer 6 μL,EcoR Ⅰ 1 μL,Xho Ⅰ 1 μL),将IGF-1酶切片段与PET-32α酶切产物16 ℃连接酶过夜连接,获得重组质粒,将其转化E.coli.BL21(DE3)感受态细胞后,涂布于LB 抗性平板(含Amp+ 100 μg/mL),37 ℃恒温需氧培养16~18 h。挑单个菌落,接种于LB肉汤(含Amp+),37 ℃ 180 r/min振荡培养12~14 h,取菌液进行PCR鉴定,选取PCR鉴定为阳性的转化子抽提质粒,EcoR Ⅰ和Xho Ⅰ 双酶切鉴定,将菌落PCR鉴定与双酶切鉴定正确的阳性克隆转化子送上海生工测序鉴定。
1.7 诱导剂IPTG浓度及诱导表达时间的优化
将重组菌BL21-IGF-1接种于LB肉汤(含Amp+)37 ℃ 220 r/min振荡培养12 h,按1∶100比例转种到LB肉汤(含Amp+)中培养至OD600=0.5时,加入IPTG溶液使终浓度分别为0,0.1,0.2,0.3,0.5,0.8,1.0 mmol/L诱导10 h,收集菌体进行全菌SDS-PAGE分析。同时,当重组菌BL21-IGF-1培养至OD600=0.5时,加入IPTG溶液使终浓度达上述优化的浓度,诱导至6,8,10 h时,取1 mL菌液进行SDS-PAGE检测分析。
1.8 表达产物的定位分析及Western Blot鉴定
按方法1.7优化后的结果进行重组菌BL21-IGF-1培养及诱导表达,4 ℃ 12 000 r/min(Sigma 3k15 Inc)离心10 min,弃上清,用1/10体积的PBS(pH值8.0)重悬沉淀,加入适量裂解液,在冰浴下超声破碎至溶液清亮。4 ℃ 12 000 r/min离心15 min收集上清和沉淀,沉淀用PBS重悬。取少量上清液和沉淀重悬液,加入等体积的5×Loading Buffer,SDS-PAGE分析。破碎后离心收集的上清液中,加等体积的平衡缓冲液(20 mmol/L Tris-HCl,8 mol/L尿素,500 mmol/L NaCl,5 mmol/L 咪唑,pH值8.0)混匀,0.45 nm滤膜过滤,滤液按照上海生工公司Ni-NTA SefinoseTM Resin Kit试剂盒使用说明操作。洗脱蛋白经10 kDa超滤管浓缩。将诱导表达和未诱导的产物与纯化的融合蛋白先行SDS-PAGE分析,转PVDF膜,再进行Western Blot分析,一抗为兔抗人IGF-1,二抗为HRP标记的羊抗兔IgG。
2 结果与分析
2.1 藏猪IGF-1全基因及成熟肽序列的扩增
以抽提的藏猪肝组织RNA为模板,RT-PCR扩增IGF-1基因全长序列,扩增产物经1% AGE检测,在约612 bp位置处出现与预期大小相符的单一条带(图1-A)。将目的片段扩增到克隆载体pMD19-T上,转化大肠杆菌DH5α,并对转化子进行菌落PCR鉴定(图1-B),获得 5阳性克隆,阳性菌株送成都擎科梓熙生物技术公司测序,获得碱基序列为612 bp,Blast在线比对与GenBank中猪IGF-1序列(登录号DQ121132.1)同源性达100%,结果表明克隆成功。以P3/P4为引物,pMD19-T-IGF-1为模板扩增出的IGF-1成熟肽序列,在约315 bp的位置出现单一条带,与预期相符(图1-C),未加模板的阴性对照未见条带,说明已成功扩增了IGF-1成熟肽。
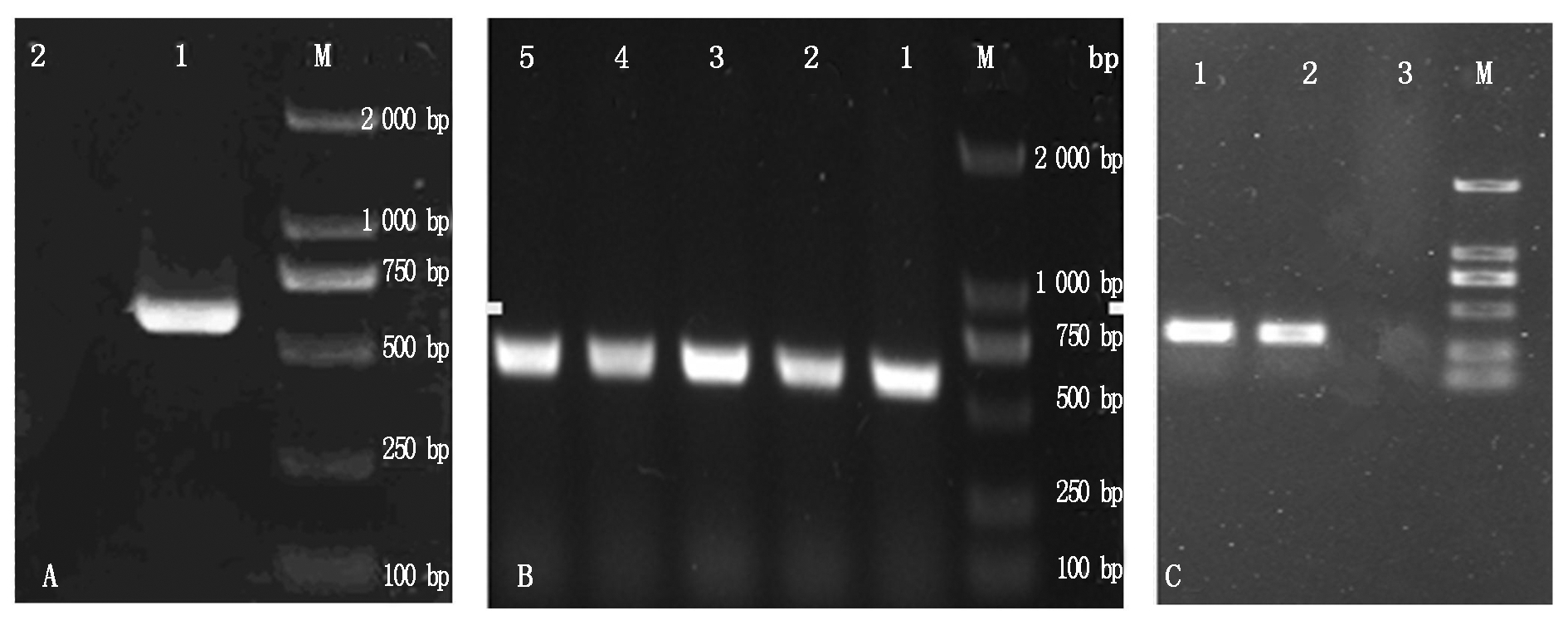
A.藏猪IGF-1全序列PCR产物; B. 菌落PCR鉴定; C. IGF-1成熟肽序列的PCR产物。M. 2 000 bp Marker;A:1. IGF-1全基因PCR产物;2.阴性对照;B:1~5.阳性菌株菌落PCR产物;C:1,2.IGF-1成熟肽序列的PCR产物;3.阴性对照。
A.PCR products of IGF-1 full sequence;B.PCR identification IGF- 1 full sequence;C.PCR products of IGF-1 mature peptide.M.DL 2000 DNA Marker;A:1.PCR product of IGF-1 full sequence;2.Negative control without template;3.PCR product of IGF-1 mature peptide;B:1-5. Positive strains of Tibetan pig;C:1,2. PCR products of IGF-1 mature peptide;3. Negative control without template.
图1 藏猪IGF-1全长序列扩增产物、pDM19-T-IGF-1菌落鉴定和成熟肽的扩增
Fig.1 The amplification of IGF-1 full sequence and identification of pDM19-T-IGF-1 colonies and IGF- 1 mature peptide PCR amplification
2.2 重组表达载体pET32α-IGF-1构建与鉴定
回收的成熟肽基因片段与质粒pET-32α分别双酶切后,连接酶连接,获取重组质粒,转化E.coli.BL21(DE3),阳性菌株进行菌落PCR鉴定,另小量提取质粒后用EcoR Ⅰ、Xho Ⅰ双酶切鉴定,均可得到约315 bp 的IGF-1序列片段,与预期产物一致(图2),质粒送公司测序鉴定,正确的转化子命名为BL21-IGF-1。
2.3 诱导融合蛋白表达IPTG浓度的优化
采用0.1,0.2,0.3,0.5,0.8,1.0 mmol/L 5种IPTG终浓度进行诱导重组菌BL21-IGF-1表达融合蛋白,SDS-PAGE分析。以未诱导重组菌为对照,发现在31 kDa大小处出现特异性条带,当IPTG浓度从0.1 mmol/L升到0.5 mmol/L,融合蛋白的表达量明显增加,但IPTG浓度在0.8~1.0 mmol/L时对融合蛋白表达量的影响不明显(图3)。因此,选择IPTG的诱导浓度为0.5 mmol/L。
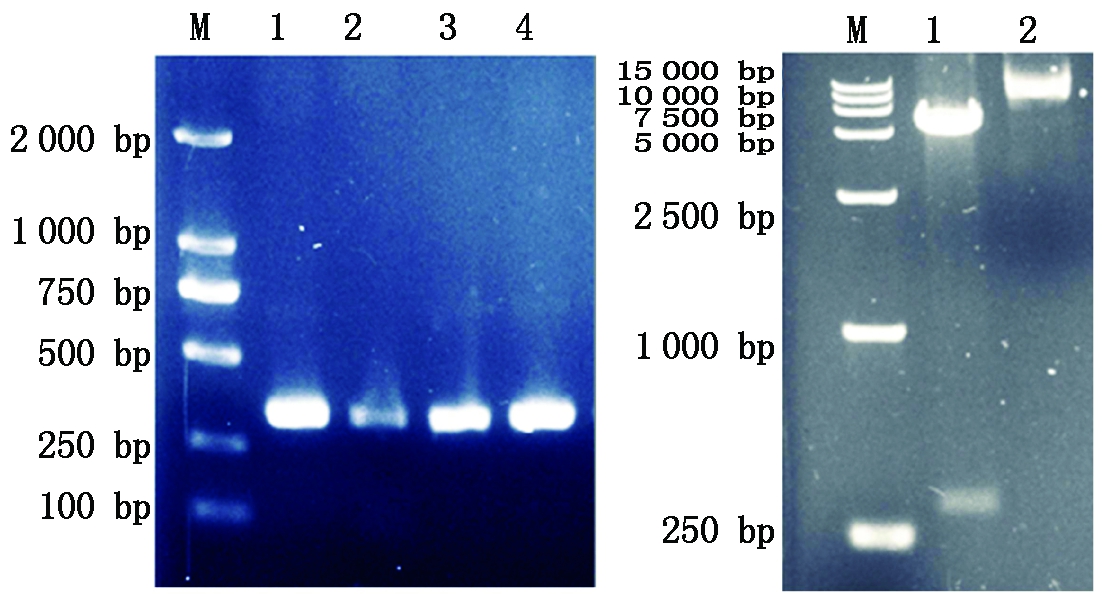
A. pET32α-IGF-1重组质粒的PCR鉴定;M. DL2000 Marker;1~4. 阳性克隆菌落PCR鉴定;B. pET32α-IGF-1重组质粒的双酶切鉴定;M.DL15000 Marker;1. 重组质粒pET32α-IGF-1的EcoR Ⅰ/Xho Ⅰ双酶切鉴定;2.重组质粒pET32α-IGF-1。
A .PCR Identification of recombinant plasmid pET32α-IGF-1;M.DL2000 DNA Marker ;1-4.Positive strains;B .Identification of recombinant plasmid pET-32α-IGF-1 by restriction enzyme digestion;M.DL15000 DNA Marker;1. pET32α-IGF-1 digested by EcoR Ⅰ/Xho Ⅰ;2.Recombinant plasmid pET32α-IGF-1.
图2 阳性克隆子pET32α-IGF-1的菌落 PCR及酶切鉴定
Fig.2 Identification of recombinant plasmid pET32α-IGF-1 by Colony PCR and restriction enzyme digestion
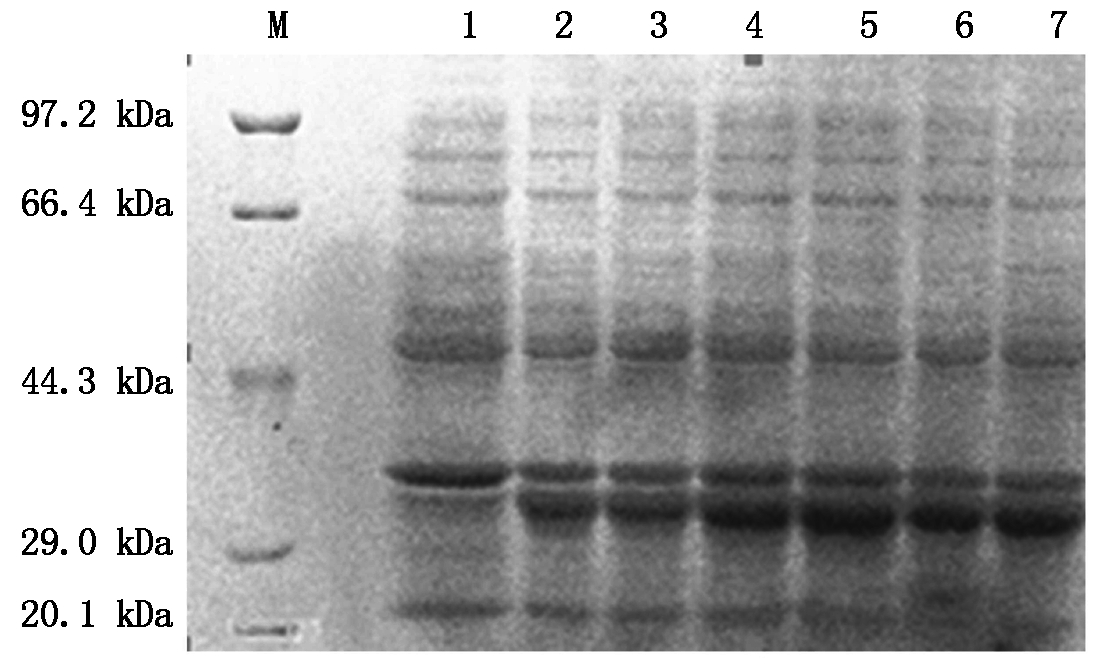
M. 标准蛋白分子量;1.未诱导;2~7.分别为0.1,0.2,0.3,0.5,
0.8,1.0 mmol/L IPTG对融合蛋白IGF-1的诱导表达。
M. Marker of standard protein;1. BL21-IGF1 without IPTG induction;2-7. Induced fusion protein expression with 0.1,0.2,0.3,0.5,0.8,1.0 mmol/L IPTG.
图3 IPTG浓度与融合蛋白表达量的SDS-PAGE分析
Fig.3 SDS-PAGE analysis of the relationship between concentration of IPTG and fusion protein expression
2.4 不同诱导时间的优化
为了探索融合蛋白表达的最优IPTG诱导时间,以未诱导的和空载体的菌液作对照,SDS-PAGE分析6,8,10 h融合蛋白表达量,结果显示,在IPTG诱导的各个时间段,重组菌BL21-IGF-1均在31 kDa处出现特异性条带,并且随着诱导时间的延长表达量增加,未经IPTG诱导和空载体菌在31 kDa处均未见有明显条带(图4),因此,选择10 h作为IPTG诱导表达的最佳时间。
2. 5 pET32α-IGF-1融合蛋白表达的可溶性分析
将诱导表达的菌液经过超声波破碎后,离心分别收集上清和沉淀,SDS-PAGE分析,结果表明,IGF-1融合蛋白主要以包涵体的形式表达于菌体中,上清有少量的表达产物(图5)。

M.标准蛋白分子量;1.未诱导;2. pET-32α空载体诱导;
3-5.IPTG诱导表达时间为6,8,10 h。
M.Marker of standard protein; 1. BL21-IGF-1 without
IPTG induction; 2. pET-32α-BL21(DE3) with IPTG induction;3-5.Expression of pET-32α-IGF-1 with 6,8,10 h IPTG induction.
图4 诱导时间与融合蛋白表达量的SDS-PAGE分析
Fig.4 SDS-PAGE analysis of relationship betweeninduction time of IPTG and fusion protein expression
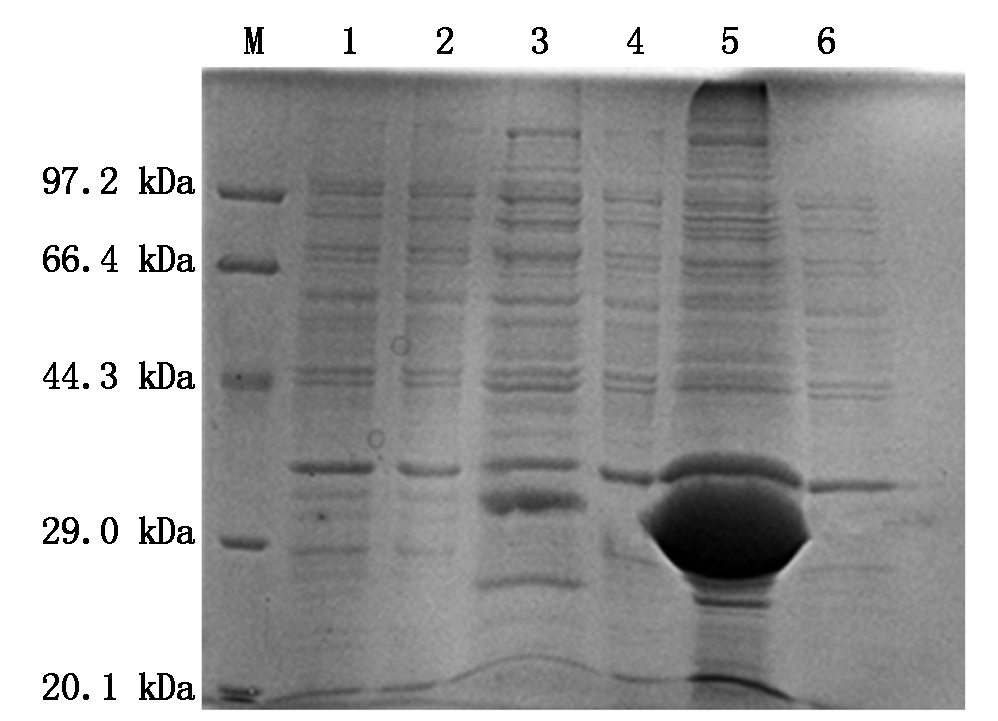
M.标准蛋白分子量;1.pET32α空载体的IPTG的诱导;2.未诱导;
3.裂解上清;4.未诱导上清;5.裂解沉淀;6.未诱导沉淀。
M.Marker of standard protein; 1. pET-32α-BL21(DE3) with IPTG
induction;2.Expression without IPTG induction;3.Supernatant of lysate;
4.Supernatant without induction;5.Precipitation of lysat of lysate;
6.Precipitation without induction.
图5 pET32α-IGF-1融合蛋白的可溶性分析
Fig.5 Solubility analysis of pET32α-IGF-1 protein
2.6 融合蛋白纯化及表达产物Western Blot鉴定
利用融合蛋白中的组氨酸标签,通过固定化金属亲和层析来纯化上清中的IGF-1蛋白,用洗脱液(含250 mmol/L)洗脱,洗脱液通过用10 kDa的超滤管浓缩得到纯度较高的融合蛋白(图6-A)。Western Blot鉴定结果,未诱导的重组菌BL21-IGF-1菌体超声后上清和沉淀未出现特异性条带,而诱导后的重组菌BL21-IGF-1菌体超声破碎后的上清、沉淀以及纯化后蛋白均出现了特异性条带(图6-B、C)。
3 讨论与结论
本研究以藏猪肝组织总RNA为模板,通过RT-PCR成功扩增出IGF-1全长序列,长度612 bp,设计引物P3/P4,以pMD19-T-IGF-1为模板扩增出IGF-1成熟肽序列315 bp,定向插入pET-32α质粒中,经菌液PCR、EcoR Ⅰ/Xho Ⅰ双酶切和测序鉴定,结果表明成功构建了pET-32α-IGF-1原核表达质粒。本试验所选用的pET-32α,由于连有T7噬菌体转录系统,强大的T7启动子受控于T7 RNA聚合酶,宿主细胞可提供T7 RNA 聚合酶,其合成mRNA速度快,是普通大肠杆菌合成mRNA速度的5倍;而携带pET-32α表达质粒受到充分诱导时,绝大多数细胞内的资源用于表达目的蛋白[14-15]。目前载体常用与本身溶解性高的多肽序列融合表达,或与催化二硫键形成的酶融合表达如硫氧还蛋白(Trx),提高目的蛋白可溶性比例及活性[16-17]; His·Tag是常用的纯化蛋白的融合标签,可以将蛋白在完全变性条件下溶解,结合于固化的Ni2+树脂而进行亲和纯化,从而提高蛋白纯化效率[18]。孟星宇等[19]曾用Trx标签成功表达了梅花鹿IGF-1融合蛋白,pET-32α是融合型原核表达载体,融合标签为6×His Tag。因此,本试验将成功克隆得到的IGF-1成熟肽序列并选用pET-32α质粒构建藏猪IGF-1成熟肽表达载体。重组大肠杆菌BL21-IGF-1加入IPTG诱导蛋白表达时,当IPTG诱导浓度从0.1 mmol/L增加到0.5 mmol/L,蛋白的表达量也随之增加,0.8~1.0 mmol/L时,蛋白的表达量受诱导浓度的影响不大,考虑到IPTG的毒性以及IPTG与蛋白表达量的关系,确定IPTG的最佳诱导浓度为0.5 mmol/L。同时,发现蛋白表达量随IPTG诱导时间延长而增加,诱导10 h时表达量最高,因此诱导时间10 h为最佳。pET-32α-IGF-1重组质粒在BL21(DE3)中诱导表达的蛋白大小约为31 kDa,与理论值一致。本试验选择的BL21(DE3)为蛋白酶缺陷形菌株,缺乏纯化过程中降解蛋白的lon 蛋白酶及 ompT 外膜蛋白酶,实现目的蛋白在菌株中的稳定表达。但在未诱导的重组菌和携带空载体的细菌诱导的对照组中,也出现与目的蛋白大小相近的杂蛋白,推测可能是大肠杆菌BL21(DE3)菌自身表达大小相似的蛋白所致。进一步对表达的融合蛋白进行Western Blot鉴定,结果发现,在诱导的重组菌菌体的破碎上清液和沉淀以及纯化的融合蛋白中能检测到分子质量约31 kDa有特异性蛋白条带,而未诱导的菌体破碎上清液和沉淀均未出现特异性条带,与SDS-PAGE结果相符,说明重组菌表达的融合蛋白是猪IGF-1成熟肽且具抗原抗体反应活性。
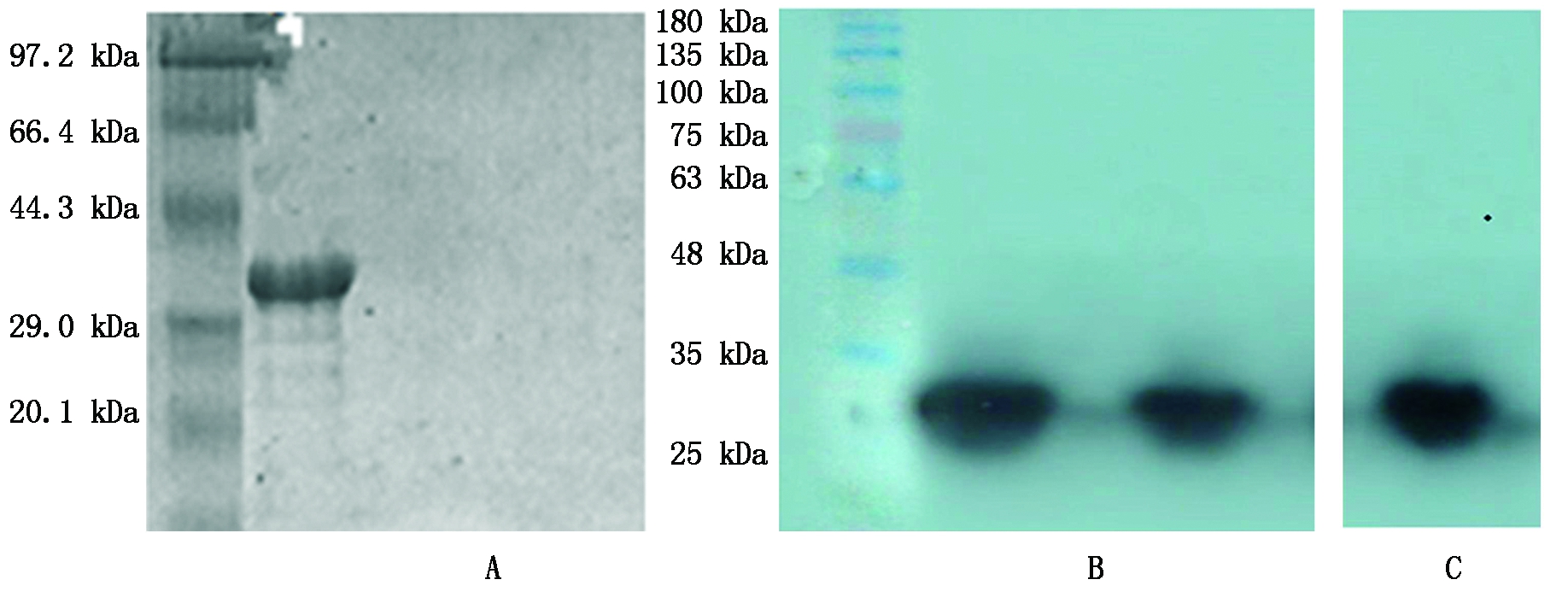
A.纯化融合蛋白;M.蛋白标准分子量; 1.纯化的融合蛋白洗脱液(含250 mmol/L 咪唑);2~3.结合洗涤液(含10 mmol/L咪唑);B.IGF-1重组蛋白的Western Blot鉴定;M.标准蛋白分子量;1.诱导菌体裂解沉淀;2.未诱导菌体裂解沉淀;3诱导菌体裂解上清;4.未诱导菌体裂解上清;C.纯化目标蛋白。
A.Purify of IGF-1 fusion protein;M.Protein Marker;1.Elution Buffer (contain 250 mmol/L imidazole);2-3.Binding /wash Buffer (contain 10 mmol/L imidazole); B.Western Blot identification of expression protein;M.Protein Marker;1.Supernatant of lysate; 2.Precipitation of lysat without induction; 3.Precipitation of lysat;4.Pernatant of lysate without induction; C.Western Blot identification of purified protein.
图6 IGF-1融合蛋白的纯化及表达产物Western Blot鉴定
Fig.6 Purify of IGF-1 fusion protein and identification by Western Blot
通过目标融合蛋白可溶性分析试验结果可知,蛋白主要以包涵体的形式存在,而在菌体破碎的上清液中仍有少量存在。破碎菌体上清液中的可溶蛋白的分离纯化可操作性优于包涵体蛋白,所以本试验的目标蛋白纯化是对重组菌菌体破碎的上清蛋白进行纯化。有关IGF-1重组蛋白表达后的活性问题,樊汶樵[20]研究发现,原核表达出来的IGF-1重组蛋白能显著刺激鱼的肾脏传代细胞CIK细胞增殖,具有较强的生物活性。孟星宇等[19]研究发现,原核表达出来的IGF-1重组蛋白能提升细胞的增殖速度。Zeng等[5] 给猪注射牛或人的IGF-1,结果表明,IGF-1与猪的平均日增重有着较大相关性,猪的肌肉生长加快,肌肉中总蛋白和总的IGF-1 mRNA丰度上升。本试验成功获得了高纯度的藏猪IGF-1成熟肽融合蛋白,为深入研究IGF-1融合蛋白生物学特性及其在畜牧业生产中的应用提供基础理论依据。
通过RT-PCR成功扩增出藏猪IGF-1成熟肽基因序列,构建了表达质粒pET32α-IGF-1及获得重组大肠杆菌BL21-IGF-1,成功表达了藏猪IGF-1成熟肽融合蛋白。
[1] Tse M C L, Chan K M, Cheng C H K. Cloning, characterization and promoter analysis of the common carp IGF-Ⅱ gene[J]. Gene, 2008, 412(1-2):26-38.
[2] Yigiter A B, Kavak Z N, Durukan B, et al. Placental volume and vascularization flow indices by 3D power Doppler US using VOCAL technique and correlation with IGF-1, free beta-hCG, PAPP-A, and uterine artery Doppler at 11-14 weeks of pregnancy.[J]. Journal of Perinatal Medicine, 2016, 39(2):137-141.
[3] Zi X D, Mu X K, Wang Y. Variation in sequences and mRNA expression levels of growth hormone (GH), insulin-like growth factor I (IGF-I) and Ⅱ (IGF-Ⅱ) genes between prolific Lezhi black goat and non-prolific Tibetan goat (Capra hircus)[J]. General Comparative Endocrinology, 2013, 187(1):1-5.
[4] Tang S, Sun D, Ou J, et al. Evaluation of the IGFs (IGF-Ⅰ and IGF2) genes as candidates for growth, body measurement, carcass, and reproduction traits in Beijing You and Silkie chickens[J]. Animal Biotechnology, 2010, 21(2):104-113.
[5] Zeng C, Liu X L, Wang W M, et al. Characterization of GHRs, IGFs and MSTNs, and analysis of their expression relationships in blunt snout bream, Megalobrama amblycephala[J]. Gene, 2014, 535(2):239-249.
[6] Dubey P, Nath A, Chandra V,et al. Expression of mRNA encoding IGF-Ⅰ,IGF-Ⅱ, Type-Ⅰ, and Ⅱ IGF-receptors and IGF-binding proteins-1-4 during ovarian follicular development in Buffalo (Bubalus bubalis)[J]. Animal Biotechnology,2015, 26(2):81-91.
[7] 刘西梅,华再东,李 莉,等.转IGF-1基因猪的诱导表达[J].基因组学与应用生物学,2016,35(6):1352-1356.
[8] Cooke R M, Harvey T S, Campbell I D. Solution structure of human insulin-like growth factor 1:a nuclear magnetic resonance and restrained molecular dynamics study [J]. Biochemistry, 1991, 30(22):5484-5491.
[9] Li M, Tian S, Jin L, et al. Genomic analyses identify distinct patterns of selection in domesticated pigs and Tibetan wild boars[J]. Nature Genetics, 2013, 45(12):1431-1438.
[10] Kang R, Ji G, Yang X, et al. Investigation on host susceptibility of Tibetan pig to infection of porcine reproductive and Respiratory syndrome virus through viral challenge study[J]. Journal of Chemical Physics, 2016, 82(5):2300-2304.
[11] Suzuki K, Nakagawa M, Katoh K, et al. Genetic correlation between serum insulin-like growth factor-1 concentration and performance and meat quality traits in Duroc pigs[J]. Journal of Animal Science, 2004, 82(4):994-999.
[12] Bo Zhang, Yangzong Qiangba, Peng Shang, et al. Gene expression of vascular endothelial growth factor A and hypoxic adaptation in Tibetan pig[J]. Journal of Animal Science and Biotechnology, 2016, 7(1):1-8.
[13] 李 伟,张飞燕,宋婷婷,等.藏猪与雅南猪IGF-I基因的克隆与序列分析[J].浙江农业学报, 2015, 27(8):1324-1330.
[14] 刘 侃,汪 炬,谢秋玲,等.重组类胰岛素样生长因子-Ⅰ的纯化与复性[J].中国生物工程杂志, 2006, 26(2):29-33.
[15] Pollak, Michael N, Eva S,et al.Insulin-like growth factors and neoplasia[J].Nature Review,2004(4):505-518.
[16] Caschera F, Noireaux V. Compartmentalization of an all-E.coli cell-free expression system for the construction of a minimal cell[J]. Artificial Life, 2016,22(2):1-11.
[17] Hammarström M, Hellgren N, Berg S V D, et al. Rapid screening for improved solubility of small human proteins produced as fusion proteins in Escherichia coli[J]. Protein Science, 2002, 11(2):313-321.
[18] Yan W, Liu X L, Xiao H W, et al. Expression pattern and prokaryotic expression for peking duck insulin-like growth factor-I in Escherichia coli[J]. Biochemical Genetics, 2009, 47(11-12):802-811.
[19] 孟星宇,李 婷,李 沐,等.梅花鹿IGF-1的原核表达与纯化[J]. 西北农林科技大学学报:自然科学版, 2012(7):7-13.
[20] 樊汶樵.鲤鱼类胰岛素生长因子-Ⅰ的克隆和原核表达研究[D].雅安:四川农业大学,2007.