利用矮化砧木嫁接品种控制树体高度是实现苹果矮化密植栽培的重要途径之一[1]。前人对砧木矮化机理的研究主要集中在砧穗解剖结构、同化物运输、相关酶活性及激素含量等方面,而在赤霉素合成的基因方面少有报道[2]。赤霉素是一种广泛存在于植物中的二萜类化合物,能控制多种植物发育和生理过程,当赤霉素合成被抑制或者信号传导被阻遏将导致植株矮化。赤霉素的合成受到多种酶的调控,目前的研究表明,GA20氧化酶是植物体内赤霉素生物合成中最重要的限速酶[3],它能催化从GA12到GA9及GA53到GA20一系列的氧化反应过程,形成具有生物活性的GAs。在拟南芥、玉米、水稻、小桐子、葡萄、梨等多种植物中,GA20氧化酶基因已被克隆并进行了功能研究[4-14],表明该基因属于一个多基因家族,其功能的缺失将导致植株表现矮化性状。
SH系是山西省农科院果树研究所用国光与河南海棠杂交选育而成并在华北、西北地区广泛应用的矮化砧木,但在河北省部分地区由于SH系抗盐碱能力弱,容易出现黄化现象[15]。河北农业大学苹果课题组以SH40为母本经自然杂交实生选育出一批新型矮化砧木,其中2号和36号表现出控制品种树体矮化、早花早果性良好等特点。因此,本试验以新型矮化砧木2号和36号为试材,设计特异引物利用RT-PCR法克隆GA20氧化酶基因cDNA的CDS序列,并分析该基因的生物信息学特征以及在不同时期砧木和嫁接品种内GA20氧化酶基因的表达情况,以期为矮化机理的研究提供理论依据。
1 材料和方法
1.1 试验材料和试剂
试材取自河北省保定市河北农业大学苹果试验园。试验材料为苹果矮化砧木2号/八棱海棠、36号/八棱海棠,以及砧穗组合天红2号/2号/八棱海棠、天红2号/36号/八棱海棠,分别用于GA20ox1基因的克隆及表达分析。
多糖多酚植物总RNA提取试剂盒、cDNA第一链合成试剂盒购于北京天根生化科技有限公司;Taq酶、DNA Marker、克隆载体pMD19-T等购于大连宝生物工程有限公司;DNA回收试剂盒、DH5α感受态细胞等购于上海生工生物工程股份有限公司,其他试剂均为普通国产分析纯。
1.2 试验方法
1.2.1 矮化砧木总RNA的提取及cDNA第一条链的合成 于2015年6月5日采集2号和36号砧木茎尖的幼嫩叶片,经液氮速冻后保存于-80 ℃冰箱中。将试验材料按照总RNA提取试剂盒和cDNA第一链合成试剂盒的使用说明书提取RNA并反转录成cDNA。用1%琼脂糖凝胶进行电泳,以检测RNA的完整性。
1.2.2 GA20氧化酶基因(GA20ox1)编码序列的克隆与鉴定 参照NCBI上已发表物种的GA20氧化酶基因序列,利用基因的保守性设计一对特异引物F:5′-CCTCCTCCCCCAACTCACATAC-3′和R:5′- TCAGGCCTACCACCTCTGTTC-3′,采用RT-PCR方法扩增试材中GA20ox1基因开放阅读框(ORF)序列的全长。PCR扩增程序为 94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火 35 s,72 ℃延伸1 min,共35个循环;72 ℃终延伸8 min。PCR产物经1.0%琼脂糖凝胶检测后,切胶回收并连接pMD19-T载体,转化DH5α感受态细胞。经菌液PCR鉴定蓝白斑筛选后,挑取阳性克隆送至上海生工生物工程股份有限公司进行测序。
1.2.3 生物信息学分析 利用 DNAMAN软件对所测得的核苷酸序列进行拼接和翻译成蛋白质,将氨基酸序列与其他已知物种的进行比对,使用MEGA 6.0软件进行进化树构建;运用ProtParam(http://web.expasy.org/protparam/)、SOPMA(https://npsa-prabi.ibcp.fr/)等在线软件分析编码蛋白质的理化性质和二级结构;在NCBI BlastN、NetPhos(http://www.cbs.dtu.dk/services/NetPhos/)和ExPASy Prosite(http://prosite.expasy.org/)中进行保守结构域、磷酸化位点的预测和功能位点的分析;SignalP(http://www.cbs.dtu.dk/services/SignalP/)进行分泌蛋白分析,用WOLF PSORT (http://www.genscript.com/wolf-psort.html)软件进行亚细胞定位预测;提交到 SWISS MODEL (http://www.swissmodel.expasy.org/)程序进行三维结构同源模拟。
1.2.4 GA20ox1基因在矮化砧木及其上嫁接品种内的表达分析 根据GA20ox1基因的cDNA编码序列以 β-actin基因为内参设计一对引物(表1),对矮化砧木2号和36号及其上嫁接品种天红2号进行GA20ox1基因的表达分析,以八棱海棠为乔化对照,采样时间为2015年6月5日、7月5日和8月4日。qRT-PCR反应在 ABI 7500实时定量 PCR 仪上进行,反应体系含有2×Ultra SYBR Mixture 10 μL,上、下游引物(10 μmol/L)各0.4 μL,模板cDNA 2 μL,加入灭菌蒸馏水至20 μL。反应条件 95 ℃预变性 10 min;95 ℃变性 15 s,60 ℃退火60 s,共45个循环。每个反应重复3次,采用2-ΔΔCT算法分析反应结束后荧光值变化曲线和融解曲线的结果。用SPSS V19.0软件对数据进行差异显著性分析,Excel 2003作图。
表1 荧光定量PCR引物
Tab.1 Quantitative fluorescence PCR primers
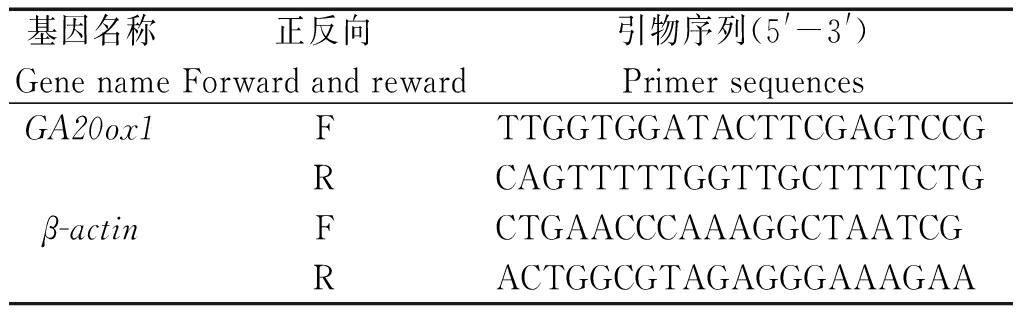
基因名称Gene name正反向Forward and reward引物序列(5'-3')Primer sequencesGA20ox1FTTGGTGGATACTTCGAGTCCGRCAGTTTTTGGTTGCTTTTCTGβ-actinFCTGAACCCAAAGGCTAATCGRACTGGCGTAGAGGGAAAGAA
2 结果与分析
2.1 苹果砧木GA20ox1基因cDNA编码序列获得
将苹果砧木2号和36号的总RNA用1%琼脂糖电泳进行检测,获得的RNA条带完整清晰(图1),说明提取的RNA完整无降解。以总RNA逆转录的cDNA第1链为模板,用设计的特异引物进行PCR扩增,扩增产物经琼脂糖凝胶电泳分离,均在1 200 bp左右获得了一条明亮的特异条带。扩增片段经回收测序,确定其全长均为1 179 bp(图2)。
图1 提取获得的RNA电泳检测结果
Fig.1 Electrophoresis results of extracted RNA
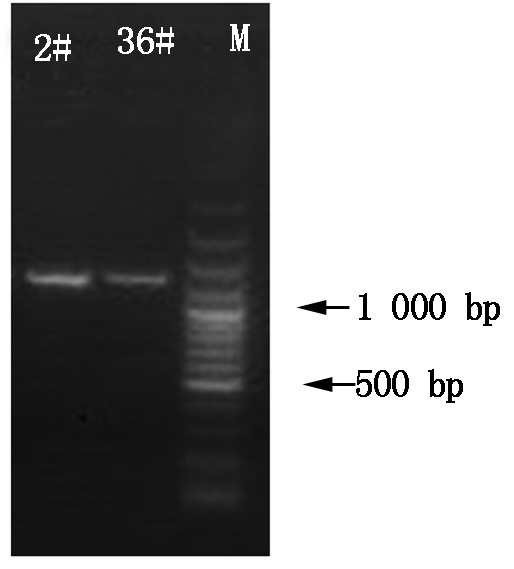
图2 PCR产物电泳检测结果
Fig.2 Electrophoresis results of PCR products
2.2 苹果砧木2号和36号GA20ox1基因序列比对
经比对分析,2号和36号GA20ox1基因cDNA编码序列有3个差异核苷酸,它们分别位于第279,648,1 032位。该序列与NCBI上苹果预测的GA20ox1基因(XM_008378540.1)编码序列对应的同等长度序列的相似性达99.8%(图3)。

图3 GA20ox1基因核苷酸序列比对
Fig.3 Nucleotide sequence alignment of GA20ox1
分析所获得的cDNA编码序列,推导获得一个由393个氨基酸(包括终止密码子)组成的蛋白序列。通过DNAMAN软件对苹果矮化砧木2号和36号GA20ox1蛋白氨基酸序列进行比对发现,2号和36号氨基酸序列相似度为100%(图4)。

图4 GA20ox1基因推导的蛋白序列比对
Fig.4 Derived protein sequence alignment of GA20ox1
2.3 苹果砧木GA20ox1基因生物信息学分析
2.3.1 GA20ox1蛋白氨基酸序列同源性及系统进
化分析 利用BlastP序列比对分析结果表明,2号和36号GA20ox1蛋白氨基酸序列与其他8个物种的氨基酸序列的相似性都在80%以上。2号和36号与苹果SH40、西洋梨、草莓、板栗、葡萄、蜜柑、茶树、黑杨的氨基酸同源性分别为96.9%,96.8%,90.1%,88.4%,88.4%,89.5%,88.8%和88.1%。
将2号和36号的GA20ox1氨基酸序列同苹果SH40(Malus domestica × Malus honanensis,KC493633.1)、西洋梨(Pyrus communis,HQ833589.1)、扁桃(Prunus dulcis,JQ412172.1)、草莓(Fragaria×Ananassa,DQ195504.1)、川桑(Morus notabilis,XM_010110754.1)、豌豆(Pisum sativum,U70471.1)、葡萄(Vitis vinifera,NM_001280982.1)、蜜柑(Citrus unshiu,LC056054.1)、蒺藜苜蓿(Medicago truncatula,XM_003592315.2)、黑杨(Populus nigra,AB089675.1)其他14个不同物种的序列用MEGA 6.0软件构建Neighbor-Joining系统进化树发现,2号和36号GA20ox1蛋白的进化符合植物学分类的规律,与同为蔷薇科的苹果SH40、西洋梨、草莓聚为同一类,之后与蒺藜苜蓿、麻风树和黑杨形成一个大的类群,说明它们的亲缘关系比较近,而和川桑、板栗、蜜柑、茶树等亲缘关系比较远(图5)。
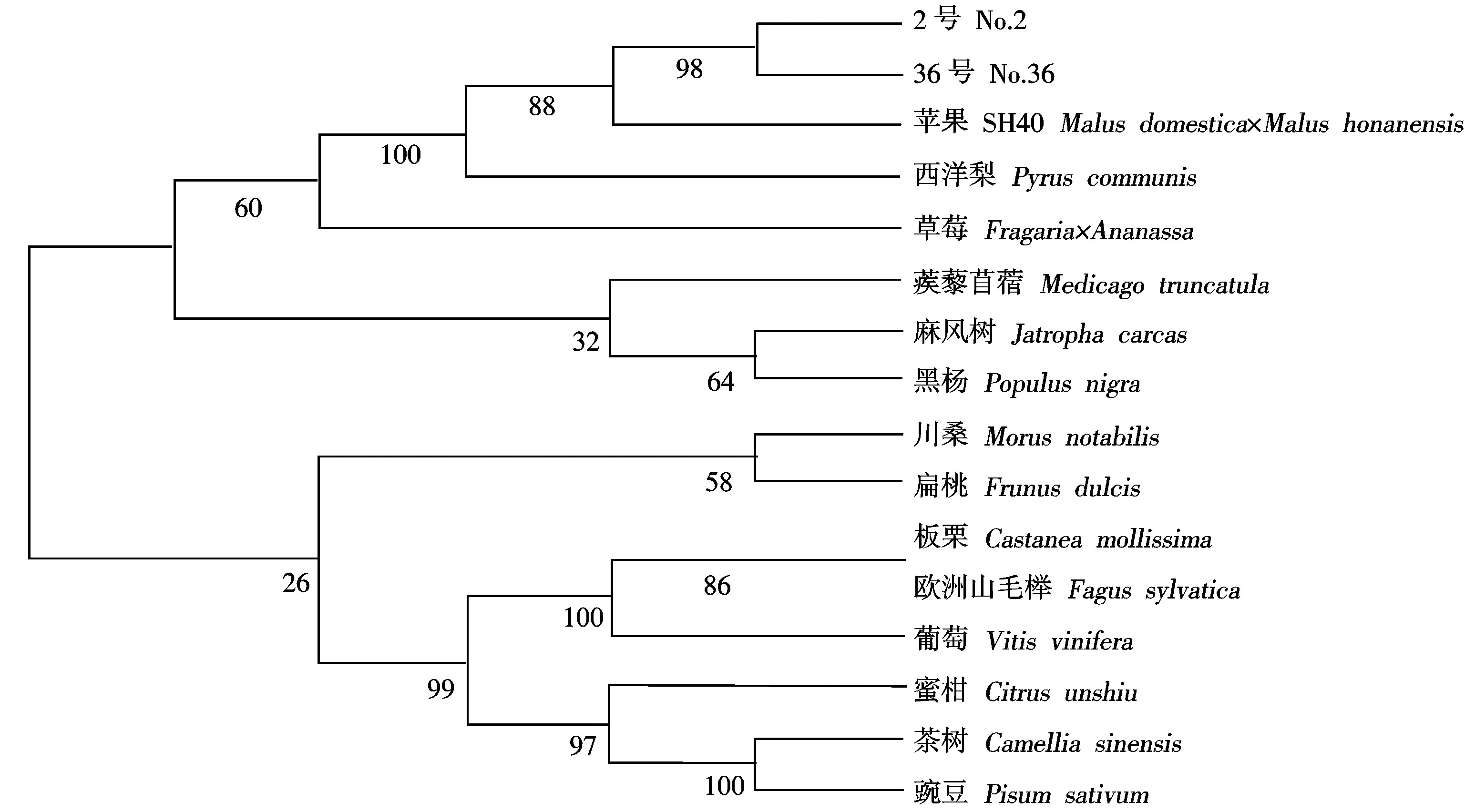
图5 2号和36号GA20ox1蛋白与其他物种GA20ox1蛋白的系统进化树
Fig.5 Phylogenetic tree in rootstocks No.2 and No.36 GA20ox1 protein and GA20ox1 protein of other plants
2.3.2 蛋白质理化性质及结构分析 用ProtParam软件预测结果显示,2号和36号GA20ox1蛋白质分子式为C1973H3036N524O594S22,总原子数6 149,其中丝氨酸(Ser)、亮氨酸(Leu)和赖氨酸(Lys)含量较为丰富。相对分子质量44.3 kDa,理论等电点5.89,带正电残基(Asp+Glu)48,带负电残基(Asp+Lys)42。不稳定系数 35.26小于40,脂肪系数 67.99,总平均亲水性-0.453小于0,说明 GA20ox1蛋白稳定且具有亲水性。
通过SOPMA对2号和36号GA20ox1蛋白氨基酸序列的二级结构进行分析,结果表明(图6)它们都含有131个α-螺旋(33.42%)、34个β-折叠(8.67%)、149个无规则卷曲(38.01%)和78个扩展链(19.9%)。用NetPhos 2.0 Server磷酸位点预测结果显示,GA20ox1蛋白有8处丝氨酸磷酸化位点、6处苏氨酸磷酸化位点和3处酪氨酸磷酸化位点。
在NCBI网站上将GA20ox1蛋白氨基酸序列与其他植物相比,结果表明,存在2个比较保守的结构域,分别是与异青霉素N合成酶相关的双加氧酶(DIOX-N)保守结构域和2-酮戊二酸和Fe2+依赖的双加氧酶超家族(20G-FeⅡ_Oxy)保守结构域。利用 ExPASy Prosite 分析该蛋白质的功能位点,结果进一步表明,保守功能域为Fe2+结合域,该保守域由第258位的His、260位的Asp和314位的His残基组成(图7)。

h.α-螺旋;e.扩展链;c.无规则卷曲;t.β-折叠。
which h, e, c and t were on behalf of Alpha helix, Extended strand, Random coil and Beta turn.
图6 GA20ox1蛋白的二级结构预测
Fig.6 Predicted secondary structure of GA20ox1 protein
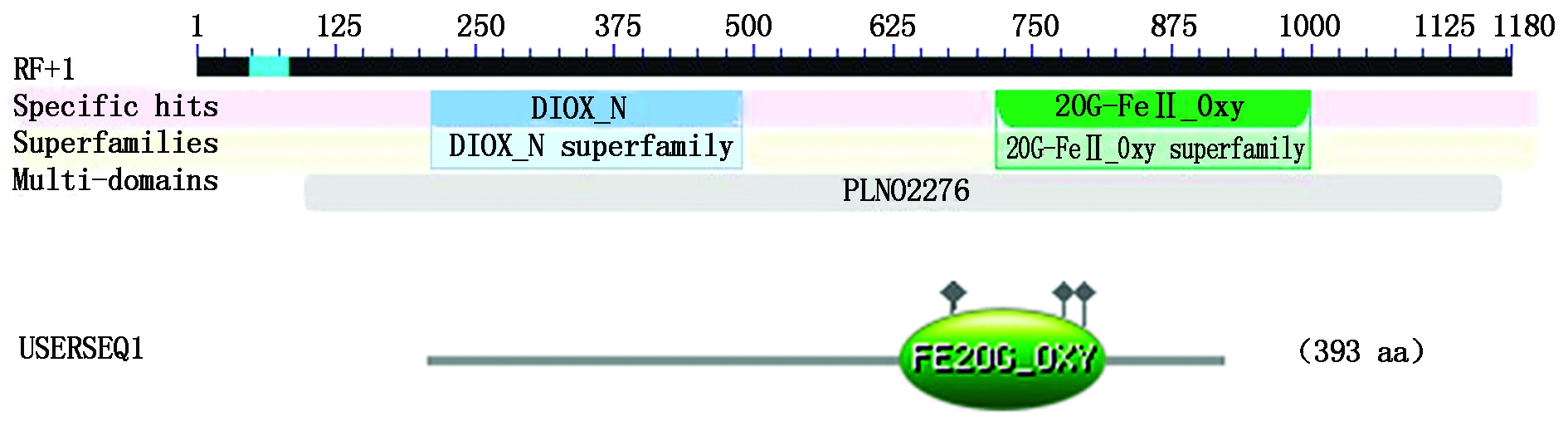
图7 GA20ox1蛋白保守结构域和功能位点预测
Fig.7 Predicted conserved domains and functional site of GA20ox1 protein
利用WOLF PSORT,预测该蛋白的亚细胞定位情况:细胞核的定位系数为10 (nucl 10.0),细胞质的定位系数为2 (cyto2.0),叶绿体的定位系数为1(chlo 1.0),因此,推测该蛋白定位于细胞核。信号肽常指新合成多肽链中用于指导蛋白质的跨膜转移(定位)N-末端的氨基酸序列[16],Signal P预测的结果显示该蛋白不具备信号肽,这与亚细胞定位预测的结果吻合。
通过SWISS MODEL程序,以拟南芥花青素双加氧酶蛋白(PDB code:2brt.1.A)预测得到的2号和36号GA20ox1蛋白质的三级结构模型如图8所示。
2.4 苹果砧木GA20ox1基因的荧光定量分析
由图9可以看出,不同时期矮化砧木2号、36号和八棱海棠以及各砧木上嫁接品种内GA20ox1基因均有表达。
各砧木内GA20ox1基因在不同时期的相对表达量有明显差异。在6-8月份,2号砧木内GA20ox1
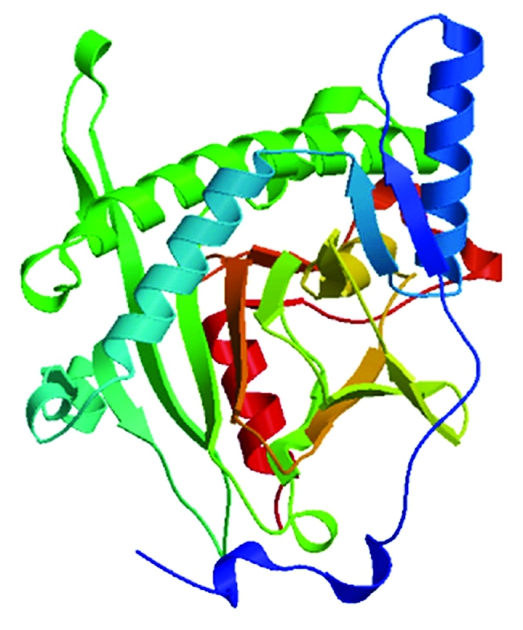
图8 GA20ox1蛋白的三级结构预测
Fig.8 Predicted tertiary structure of GA20ox1 protein
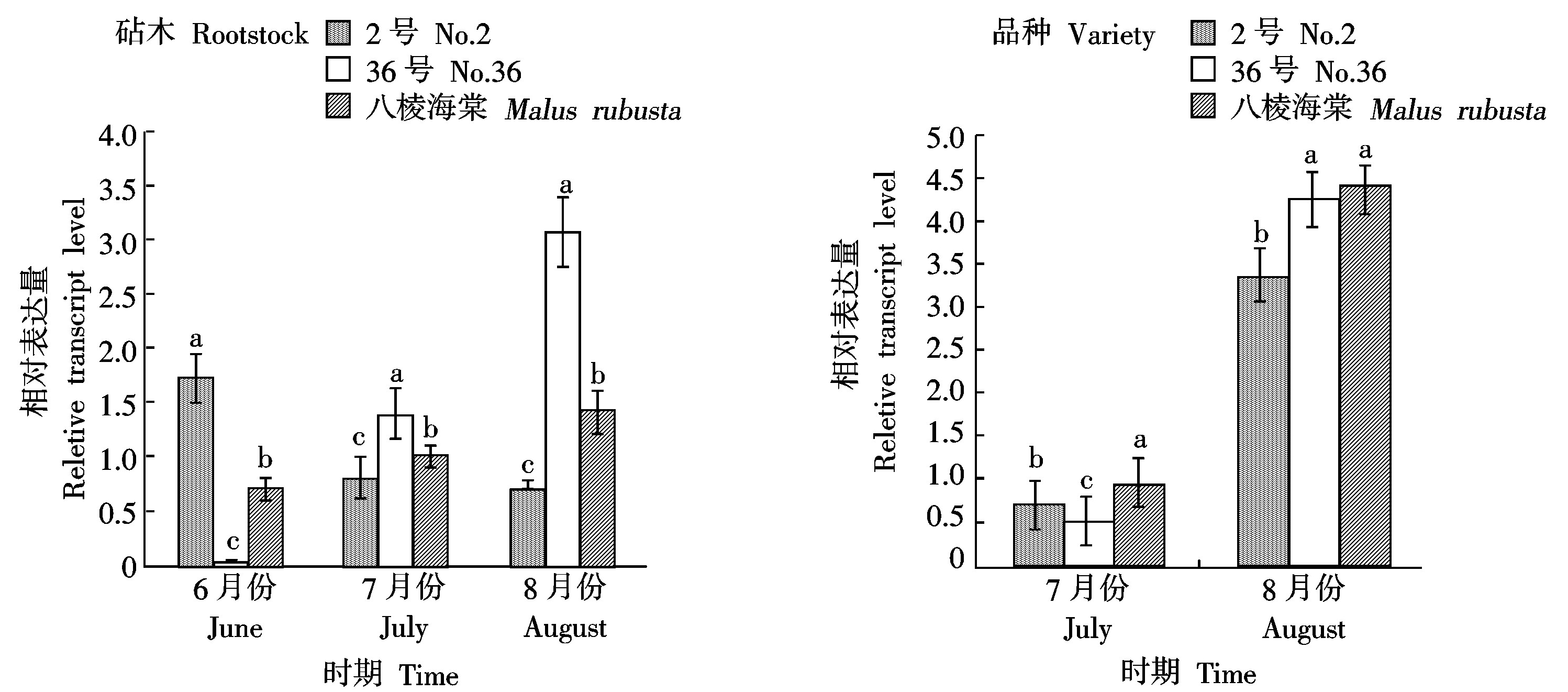
图中不同时期不同小写字母表示在P<0.05水平上差异显著。
The small-letter of each time means significantly different at the P<0.05 level.
图9 不同时期各砧木及嫁接品种内GA20ox1基因的表达
Fig.9 Relative expression of GA20ox1 of each rootstocks and varieties in different times
基因的相对表达量下降,6月份的相对表达量为1.71,显著高于八棱海棠,7-8月份则均显著低于八棱海棠。36号砧木内GA20ox1基因在6月份的相对表达量仅为0.03,显著低于八棱海棠,而在8月份上升到3.07,显著高于八棱海棠。与6月份相比,八棱海棠内GA20ox1基因的相对表达量在8月份上升到1.42。
不同时期2号、36号及八棱海棠上的品种内GA20ox1基因的表达不同。7月份2号砧木上品种内GA20ox1基因的相对表达量为0.74,36号砧木上的相对表达量为0.55,均显著低于以八棱海棠为砧木的品种。8月份八棱海棠上品种内GA20ox1基因的相对表达量为4.39,显著高于2号砧木上品种的相对表达量3.38,而与以36号为砧木的红富士树体没有差异。与7月份相比,8月份3个砧木上品种内的相对表达量均上升,并维持在较高的水平。
3 讨论
本研究从苹果矮化砧木2号和36号中首次克隆到GA20氧化酶基因,该基因CDS序列都由1 179个核苷酸组成并存在3处差异核苷酸,与苹果全基因组预测得到的序列相似性达99.8%;均编码一个393个氨基酸的蛋白质(包括终止密码子)。通过分析氨基酸序列和预测蛋白质结构域显示,GA20ox1蛋白具有20G-Fe Ⅱ_Oxy 超家族蛋白共有的Fe2+结合域。系统进化分析表明,2号和36号GA20ox1与苹果SH40的亲缘性最高,达到96.9%,并且与木本高等植物的GA20氧化酶基因的核苷酸和氨基酸序列的同源性都在80%以上。需要特别指出的是,本研究得到的GA20氧化酶基因与Kusaba等[17]从富士中克隆出的GA20ox基因(Malus × domestica,AB037114.1)的氨基酸序列同源性为93.1%,存在较大差异。肖景华[18]对番茄GA20ox基因的研究表明,番茄GA20ox多基因家族由3个成员GA20ox1、GA20ox2和GA20ox3组成,编码的氨基酸序列具有72%~76%的同源性。本试验试材为茎尖的幼嫩组织而Kusaba等[17]利用的是富士苹果的种子,苹果GA20ox基因家族的不同成员在不同组织间的特异性表达可能造成试验结果与已发表的苹果基因存在较大的差异性,具体原因有待进一步研究。
GA20氧化酶催化从GA12到GA9和GA53到GA20过程中的一系列氧化反应,最终形成具有生物活性的赤霉素。赤霉素是调控植株高矮的重要激素,GA20氧化酶基因的表达影响了植株内赤霉素的含量。本试验以实时荧光定量PCR法研究了在6-8月份苹果矮化砧木2号、36号和对照八棱海棠以及在各砧木上嫁接红富士品种内GA20ox1基因的表达情况。试验结果表明,2号砧木在6月份的GA20ox1基因表达强度显著高于对照,在7-8月份砧木及嫁接品种的表达强度均显著低于对照;36号砧木内GA20ox1基因在6月份几乎不表达而在7-8月份的表达强度显著高于对照,其上嫁接品种内的表达强度在7-8月均低于对照。本研究的田间观察发现,2号砧木的生长势较弱,属矮生型砧木;36号砧木长势旺盛,枝条发育粗壮,属非矮生型砧木。因此7-8月份GA20ox1基因在2号砧木内的表达强度显著低于对照,而在36号砧木内的表达强度显著高于对照。宣利利等[19]发现梨矮生突变体矮1号中PcGA20ox1基因表达量显著低于乔化对照早酥梨。GA20ox1基因在矮化砧木上嫁接的品种内表达强度低于对照,说明在嫁接品种内GA20氧化酶活性受到矮化砧木的抑制,矮化砧木没有能力将本身合成的赤霉素传递到接穗中,植株内赤霉素含量较低从而表现出矮化的性状。姜志昂等[20]对嫁接在不同矮化砧木上嘎啦品种内的MdGA20ox1基因分析得出,半矮化类型砧木 SH28 嫁接嘎啦的基因表达量均高于矮化类型 SH40 嫁接嘎啦,不同矮化砧木嫁接嘎啦MdGA20ox1 表达量与其生长量趋势基本相同。
[1] 马宝焜.当前苹果矮化密植栽培中存在的问题与解决途径[J].农村科技开发, 2003(7):4-5.
[2] 欧春青,姜淑苓,王 斐,等.果树矮化机理的研究进展[J].浙江农业科学, 2010,1(3):487-491.
[3] 岳 川,曾建明,曹红利,等.高等植物赤霉素代谢及其信号转导通路[J].植物生理学报, 2012,48(2):118-128.
[4] Varbanova M, Yamaguchi S, Yang Y E, et al. Methylation of gibberellins by Arabidopsis GAMT1 and GAMT2[J]. The Plant Cell, 2007, 19(1):32-45.
[5] Wen L H, Zhong W J, Huo X M, et al. Expression analysis of ABA- and GA-related genes during four stages of bud dormancy in Japanese apricot (Prunus mume Sieb. et Zucc) [J]. Journal of Horticultural Science & Biotechnology, 2016, 91(4):362-369.
[6] 王海波,邹竹荣,龚 明.小桐子赤霉素20氧化酶的基因克隆及低温下表达分析[J].生物技术通报, 2015,31(10):140-148.
[7] 孙同玉,祝 娟,孙 鹏,等.西洋参赤霉素20-氧化酶基因的克隆与序列分析[J].中草药, 2015, 46(11):1656-1660.
[8] Appleford N J, Evans D J, Lenton J R, et al. Function and transcript analysis of gibberellin-biosynthetic enzymes in wheat[J]. Planta, 2006, 223(3):568-582.
[9] Jeon H W, Cho J S, Park E J, et al. Developing xylem-preferential expression of PdGA20ox1, a gibberellin 20-oxidase 1 from Pinus densiflora,improves woody biomass production in a hybrid poplar[J]. Plant Biotechnology Journal, 2016, 14(4):1161-1170.
[10] 王 满,金 灿,许 雪,等.梨极矮化突变体与苹果梨GA20ox基因的克隆及植物表达载体的构建[J].北方园艺, 2014(2):89-94.
[11] Do P T, De Tar J R, Lee H, et al. Expression of ZmGA20ox cDNA alters plant morphology and increases biomass production of switchgrass (Panicum virgatum L.) [J]. Plant Biotechnology Journal, 2016,14(7):1532-1540.
[12] 王西成,任国慧,房经贵,等.葡萄赤霉素合成相关基因克隆、亚细胞定位和表达分析[J].中国农业科学, 2012, 45(11):2224-2231.
[13] 钟 曦,段秋红,李新梅,等.与 AtGA20ox1启动子结合的转录因子筛选分析[J].激光生物学报, 2016, 25(3):263-269.
[14] 石建斌.马铃薯赤霉素合成代谢途径关键酶基因GA2ox1,GA20ox1的克隆与功能分析[D].西宁:青海大学, 2016.
[15] 郭 静,隗晓雯,王 菲,等.不同中间砧对红富士苹果树体生长及酶活性和总酚含量的影响[J].北方园艺, 2013(21):9-12.
[16] 王铁霖,李 晶,杨玉文,等.烟草野火病菌Pseudomonas syringae pv.tabaci yuexi-1信号肽预测及分析[J].中国烟草学报, 2016, 22(1):92-100.
[17] Kusaba S, Honda C, Kano-Murakami Y. Isolation and expression analysis of gibberellin 20-oxidase homologous gene in Apple[J]. Journal of Experimental Botany, 2001, 52(355):375-376.
[18] 肖景华.番茄GA20-氧化酶和GA2-氧化酶基因的克隆与功能分析[D].武汉:华中农业大学, 2006.
[19] 宣利利,欧春青,王 斐,等.梨矮化砧木中矮1号GA20-氧化酶基因克隆与表达分析[J].果树学报, 2011(5):883-887.
[20] 姜志昂,孙建设,彭建营,等.苹果MdGA20ox1基因的克隆、亚细胞定位及表达分析[J].园艺学报, 2013, 40(12):2373-2381.