钙调蛋白(CaM)是生物细胞内一种结构保守型很强的调控蛋白,也是研究得最多的Ca2+受体蛋白,其原型是由148个氨基酸组成的小分子酸性蛋白(17 kDa),具有专一性结合钙离子的EF hand结构域[1]。CaM只有在结合Ca2+后形成Ca2+/CaM复合物才有生物活性[2]。Ca2+/CaM复合物发挥生物活性的机制主要有2种,一种是该复合物直接与下游靶蛋白相互作用,另一种是通过活化依赖Ca2+/CaM复合物的蛋白激酶起作用[2-3]。
钙调蛋白在植物体内参与多种生理活动的调节,如参与激素反应[4]、调节基因表达[5]、参与调节植物发育[6]、参与植物对许多胁迫信号的转导等[7-9]。目前,已经从小麦、大豆、玉米、烟草、香蕉、脐橙等多种植物中克隆了CaM基因,目前对CaM基因在响应胁迫信号中的功能有了初步的了解,例如拟南芥的AtCaM基因与冷胁迫信号的转导有关[10-11];另有研究表明,调控植物耐盐性相关的蛋白均受到Ca2+/CaM复合物的调控[12-13];在香蕉中,CaM被证明参与香蕉幼苗对干旱、低温等的逆境调控过程[14]。
苹果(Malus domestica)是我国的主要果品,也是世界上种植最广、产量最多的水果。市场供应的苹果多以储藏果为主,苹果从采后包装、运输、贮藏到消费者手的整个过程中都不可避免地受到挤压、振动、碰撞等导致的损伤、高温和低氧的储藏环境等逆境胁迫因素的影响,从而极易发生病害和腐烂。因此,了解苹果釆后响应逆境胁迫的生理机制,筛选关键响应因子,对开展苹果抗逆品种改良有重要的指导意义。
周倩 [15]已通过RACE技术获得MdCaM全长(GenBank登录号为HM369505),并证明MdCaM是秦冠苹果抗褐斑病关键调控基因。然而,关于MdCaM在苹果釆后逆境胁迫下的表达模式及功能尚不清楚。本研究根据MdCaM全长cDNA序列设计特异性引物,克隆了MdCaM基因。利用MEGA 5.0 软件将苹果MdCaM与其他物种的钙调蛋白氨基酸序列进行了聚类分析。同时,采用荧光定量PCR技术分析了MdCaM在苹果釆后非生物胁迫(损伤、低氧、高温)下的表达情况,明确该基因在逆境胁迫下的表达模式,旨在为进一步分析MdCaM蛋白在响应逆境胁迫中的功能,为将来开展苹果抗逆品种改良提供基因储备,为提高苹果釆后对外界胁迫环境的适应能力的研究奠定基础。
1 材料和方法
1.1 材料与试剂
试验用植物材料均采自陕西省铜川市苹果示范种植基地6年生红富士苹果树。采后当天运回实验室,用蒸馏水小心清洗且纱布擦干后,选取色泽一致、大小均匀(单果重约250 g)、无损伤病害果实进行胁迫处理,处理后果实贮存于4 ℃,相对湿度为90%的无光照储藏室中。
本研究中所用的分子试剂,高保真聚合酶Ex-Taq酶、SYBR premix EX TagTM reagent 试剂盒均购自TaKaRa公司;DNA 凝胶回收试剂购自Omega Bio-tek公司;其他分子试剂及载体等均购于生工生物工程(上海)技术服务有限公司。
1.2 逆境胁迫处理方法
1.2.1 损伤胁迫 将苹果置于离地面60 cm的地方,使其自由落地跌落大理石地面,每个苹果正反双面各跌落一次,以未处理苹果为对照,储藏于温度为4 ℃,相对湿度为90%~93%无光照储藏室中。每组设3个生物样本重复,每次取9个苹果用于样品分析。分别于处理后0,1,6,12,24 h取材,将果实削成1 cm3左右小块存于-80 ℃保存备用。
1.2.2 高温胁迫 将苹果分别置于温度为4,20,40 ℃,相对湿度为90%~93%无光照储藏室内。每组设3个生物样本重复,每次每个处理组取9个苹果用于样品分析,分别于处理后0,1,6,12,24 h取材,将果实削成1 cm3左右小块存于-80 ℃保存备用。
1.2.3 低氧胁迫 将苹果储藏于30 L的容器中,通入100%N2+0 O2和97%N2+3%O2。每组3个重复,储藏于4 ℃,相对湿度为90%~93%无光照储藏室内。每次每个处理组取9个苹果用于样品分析,分别于处理后0,1,6,12,24 h取材,将果实削成1 cm3左右小块存于-80 ℃保存备用。
1.3 果实RNA提取和MdCaM基因克隆方法
采用CTAB法提取果实样品的总RNA。利用M-MLV逆转录酶合成第一链cDNA,具体试验体系、方法和步骤见试剂盒说明书。根据苹果MdCaM基因序列全长,利用Primer 5.0设计引物(上海生工合成),MdCaM-F和MdCaM-R,序列见表1。以cDNA为模板扩增MdCaM基因全长。反应体系为25 μL,程序为94 ℃预变性5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 40 s 共35个循环;最后72 ℃延伸7 min。1%琼脂糖凝胶电泳检测后,DNA凝胶回收试剂盒回收目标片段,连接pMD19-T载体进行T/A克隆,DNA测序由上海生物工程有限公司完成。
1.4 MdCaM基因扩增及荧光定量表达分析
以上述cDNA为模板,以NCBI上已经登录的MdActin(登录号:AB638619.1)为内参,采用RT-PCR方法对其进行表达分析。引物根据NCBI已经登录的MdActin和MdCaM序列设计,分别为Q_MdActin-F、Q_MdActin-R;Q_MdCaM-F、Q_MdCaM-R,具体序列见表1。操作步骤按照SYBR premix EX TagTM reagent 试剂盒说明书进行。qPCR体系为10 μL,包括5 μL SYBR premix Ex Taq混合液,1 μL cDNA,引物各0.25 μL,ddH2O 3.5 μL。反应程序为:95 ℃变性3 min;然后,95 ℃ 20 s,54 ℃退火20 s,72 ℃延伸20 s,共40 次循环;每次循环第3 步进行荧光采集,最后退火至65 ℃,每隔30 s 上升0.5 ℃,至95 ℃变性1 min。qRT-PCR 反应于Bio-RAD C1000TM Thermal Cycler 上进行,使用CFX96TM 系统进行荧光采集。cDNA标样和待测样均设置3 次重复。试验结果用2-ΔΔCT法对数据进行定量分析[16]。
表1 扩增所用引物
Tab.1 The sequences of the primers
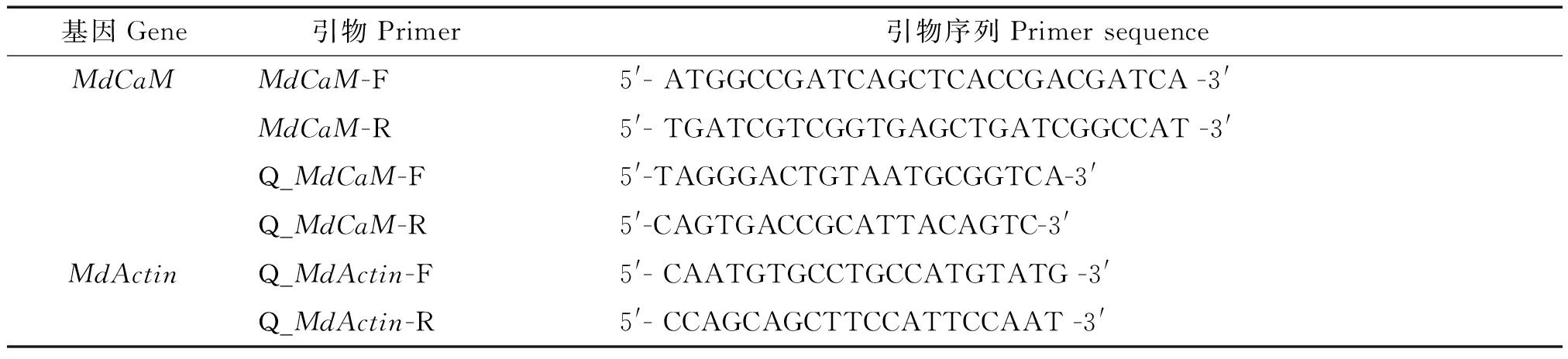
基因Gene引物Primer引物序列Primer sequenceMdCaMMdCaM-F5'- ATGGCCGATCAGCTCACCGACGATCA -3'MdCaM-R5'- TGATCGTCGGTGAGCTGATCGGCCAT -3'Q_MdCaM-F5'-TAGGGACTGTAATGCGGTCA-3'Q_MdCaM-R5'-CAGTGACCGCATTACAGTC-3'MdActinQ_MdActin-F5'- CAATGTGCCTGCCATGTATG -3'Q_MdActin-R5'- CCAGCAGCTTCCATTCCAAT -3'
2 结果与分析
2.1 MdCaM克隆的电泳检测
对红富士苹果的MdCaM基因全长序列进行克隆(图1),将测序结果与已知MdCaM基因序列比对,结果一致。MdCaM包含450 bp的开放阅读框,编码150个氨基酸。根据在线软件(http://www.expasy.org/tools/pi_tool.html)预测其分子量约为16.875 7 kDa,预测等电点(pI)为4.12。利用DNAman软件将MdCaM与其他物种的CaM氨基酸序列进行比对。结果显示,MdCaM的蛋白序列与其他物种钙调蛋白基因具有很高同源性,且具有2个钙结合蛋白的保守结构域EF-hand(图2)。
2.2 MdCaM序列的系统进化树构建
根据编码MdCaM的氨基酸序列并结合其他植物钙调蛋白基因的编码氨基酸序列,采用MEGA5.0构建了系统进化树(图3)。结果表明,MdCaM基因与芥蓝和拟南芥的亲缘关系最近。
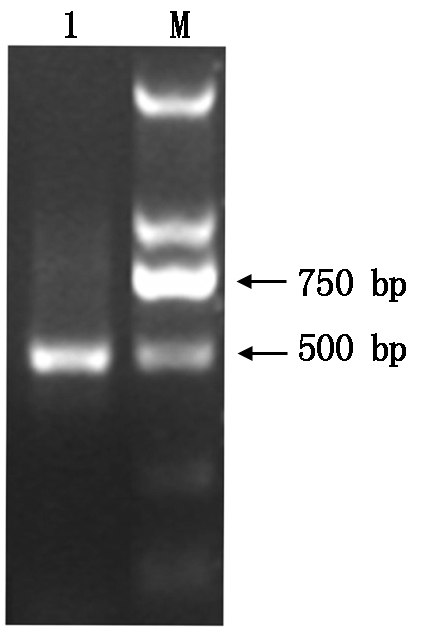
1.DNA的PCR结果;M.分子量标准。
1.PCR products corresponding to DNA samples;
M.The molecular weight standard.
图1 MdCaM基因的PCR扩增结果
Fig.1 Agarosegel electrophoresis analysis of MdCaM gene fragments
2.3 MdCaM基因在损伤胁迫下的表达分析
利用荧光定量PCR对MdCaM基因损伤胁迫后不同时间的相对表达量进行分析,结果显示:与对照组相比,MdCaM基因的相对表达量在损伤胁迫早期1,6,12 h均有显著性提高,且在损伤处理6 h后达到峰值。损伤胁迫6 h后,对照组的相对表达量为1.1,而损伤组为5.7,约为对照组的5倍,12 h后表达量较胁迫早期(1,6 h)有所下降,但仍明显高于同时期对照果,损伤处理24 h后MdCaM基因的相对表达量恢复正常水平(图4)。


黑色下划线为2个EF-hand保守结构域。
Two conserved domain EF-hands were marked by black lines.
图2 苹果MdCaM氨基酸序列和所选物种中CaM氨基酸序列比对
Fig.2 Analysis of the MdCaM amino acid sequence and these selected CaM from other plant species
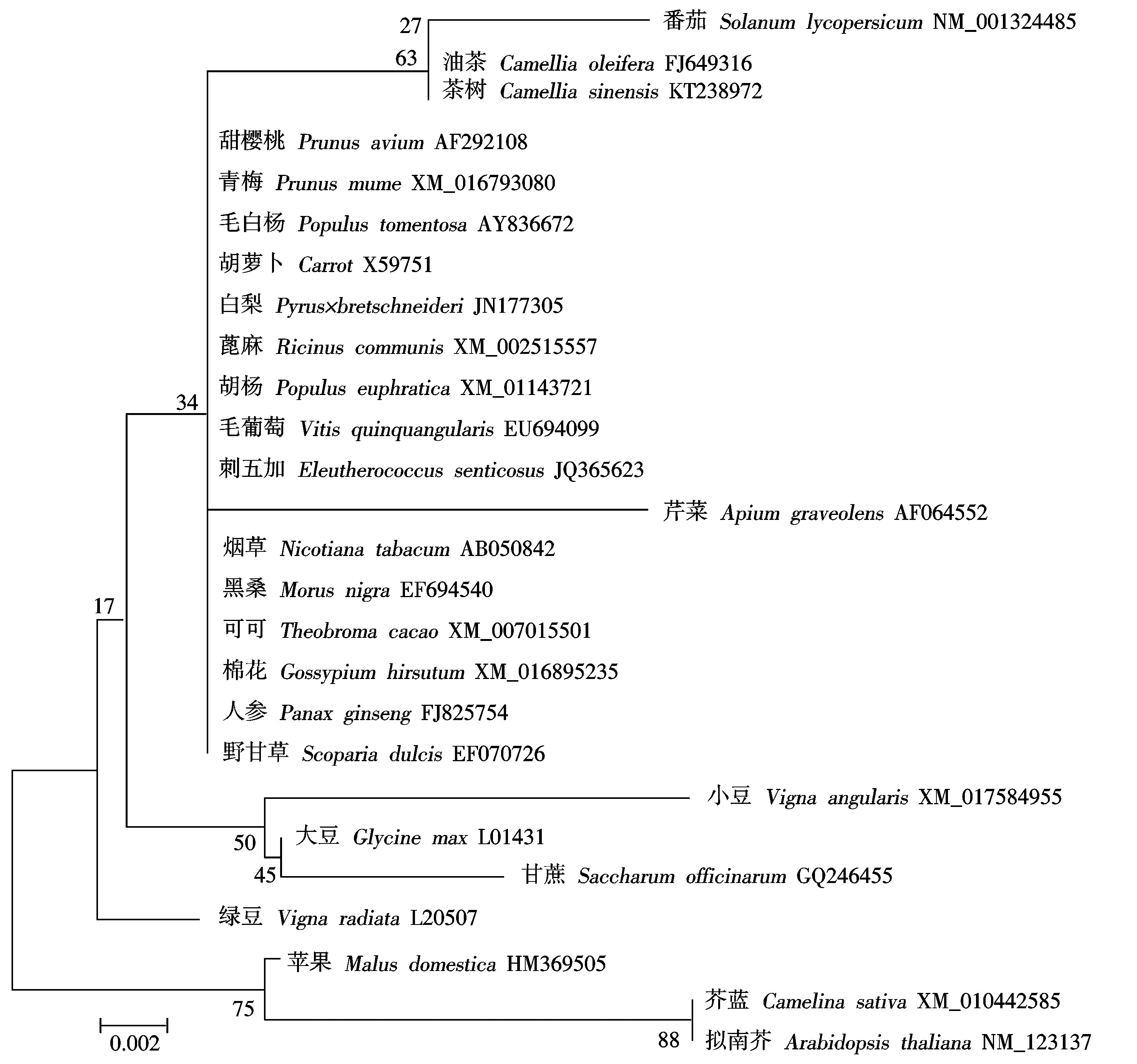
图3 根据氨基酸序列聚类的植物钙调蛋白基因进化关系分析
Fig.3 Phylogenetic relationship based on amino acid sequence among plant Calmodulin
2.4 MdCaM基因在高温胁迫下的表达分析
如图5所示,与低温(4 ℃)相比,20,40 ℃储藏1 h后,MdCaM相对表达量呈现明显上调,并随着时间的延长呈现上升趋势,12 h后达到峰值,随后表达量呈下降趋势,但显著高于同期对照组。
2.5 MdCaM基因在低氧胁迫下的表达分析
在无氧(0 O2)条件下,MdCaM在处理后1 h被迅速诱导呈上调表达,对照组的相对表达量为1.1,而无氧组为3.2,约为对照组的3倍,6 h后迅速恢复正常水平;在低氧(3% O2)储藏条件下,MdCaM仍呈现为上调表达,但在处理后6 h达到最大值,12 h后恢复正常水平。在低氧(0 O2和3% O2)诱导12 h后,MdCaM表达量与对照组无显著性差异(图6)。
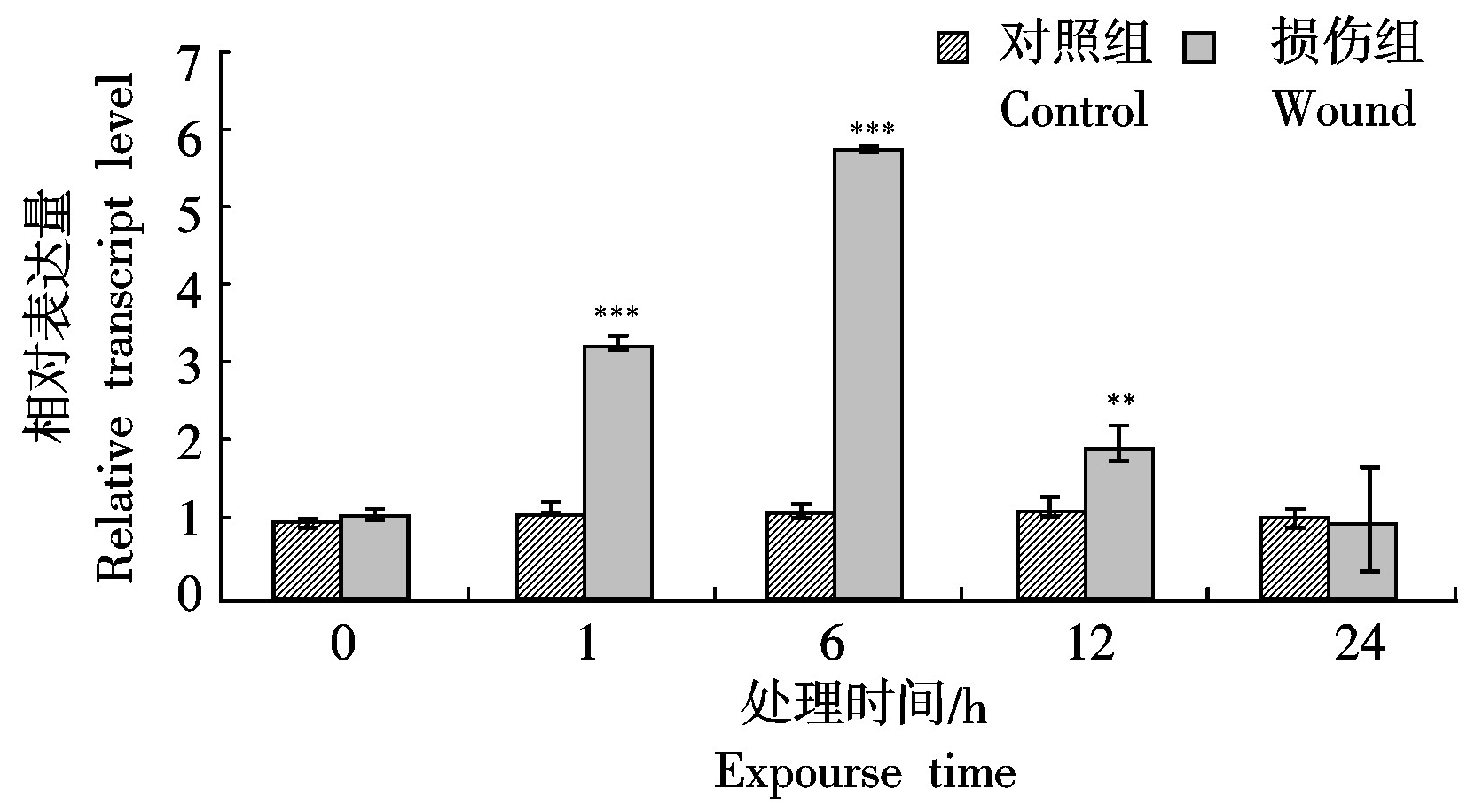
***.P<0.001;**.P<0.01; *.P<0.05。图5-6同。
***.P<0.001;**.P<0.01; *.P<0.05。The same as Fig.5-6.
图4 损伤胁迫下MdCaM基因的表达情况
Fig.4 Relative expression of MdCaM gene under wound stress
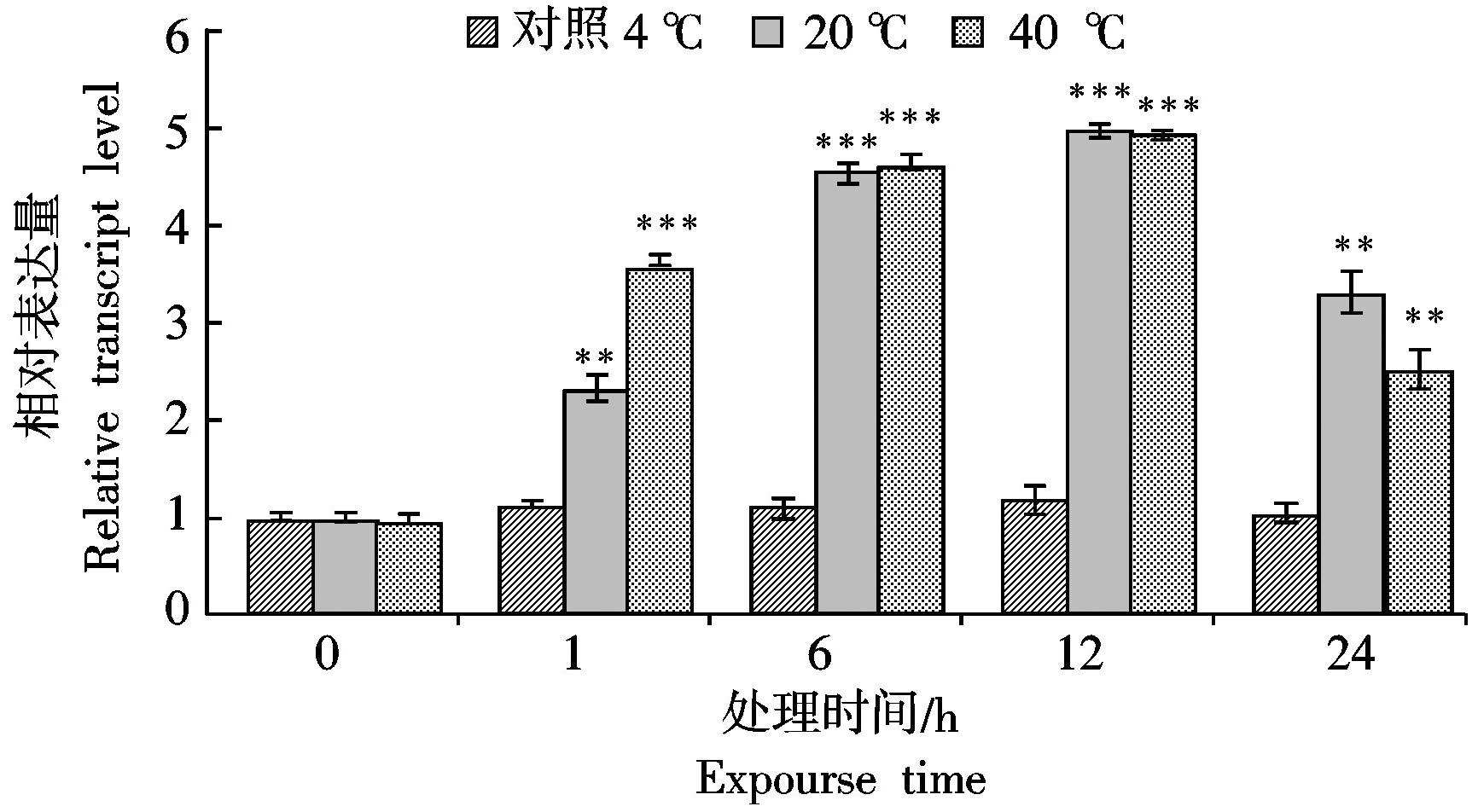
图5 高温胁迫下MdCaM基因的表达情况
Fig.5 Relative expression of MdCaM gene under high temperature stress
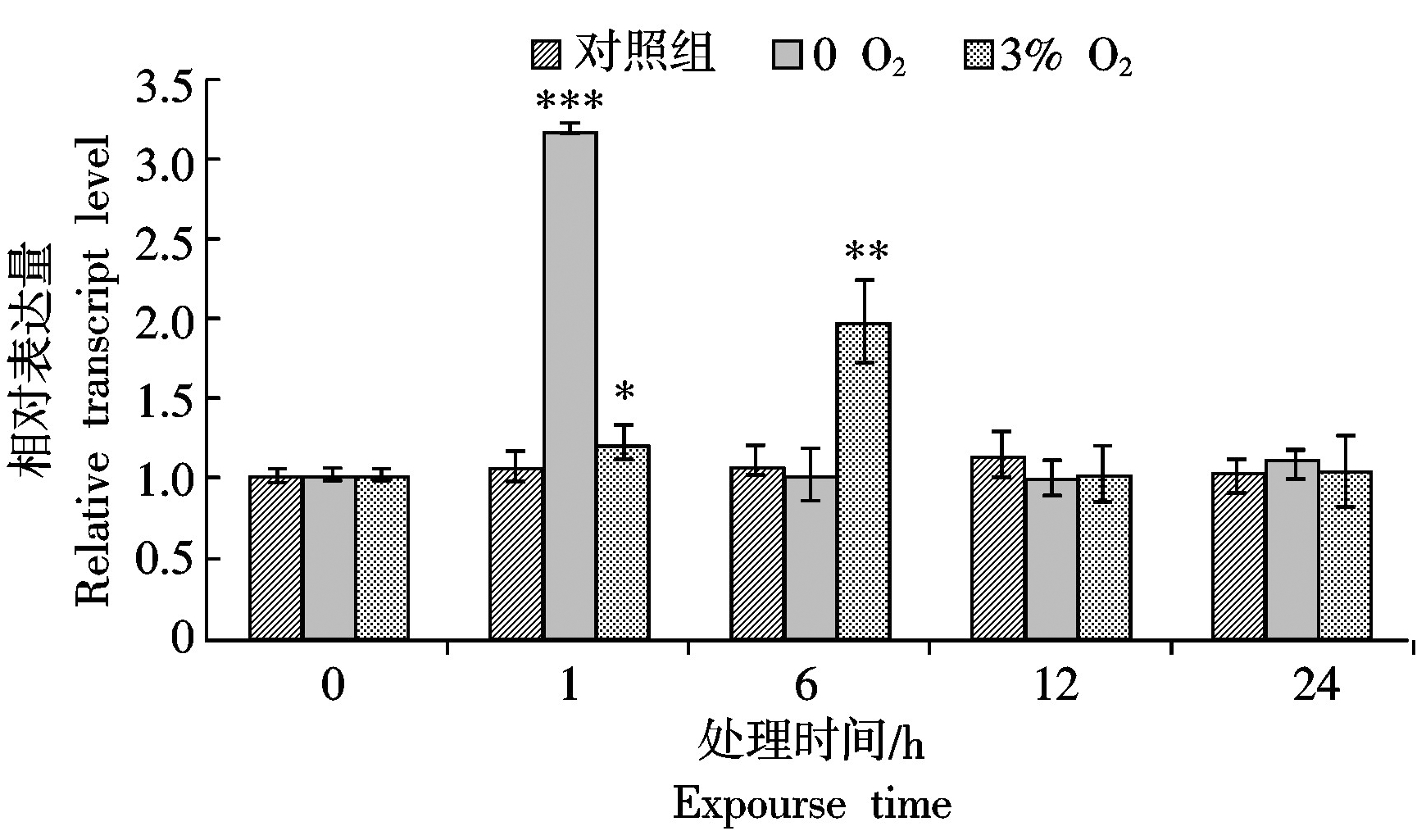
图6 低氧胁迫下MdCaM基因的表达情况
Fig.6 Relative expression of MdCaMgene under low-oxygen stress
3 讨论
植物抗逆是指植物抵抗干旱、水涝、低温、高温、盐碱、病虫害等不良环境的能力。逆境可分为生物胁迫和非生物胁迫2种。其中,非生物胁迫条件下植物自身调节机制的研究越来越受到重视,已成为培育抗逆新品种的重要条件之一。损伤、高温和低氧是苹果储藏过程中的主要非生物胁迫因子,是影响北方地区苹果储藏品质的重要因素。
已有研究表明,CaM是植物体内普遍存在的一类Ca2+结合蛋白,在植物响应非生物胁迫过程中发挥着重要作用[17-22]。钙调蛋白本身不具有催化活性,只要通过与其下游钙调蛋白结合蛋白(CaMBP)结合调控细胞的生理功能,从而影响植物的生长发育[23]。如毛白杨CaM通过提高G6PDHase、ATPase活性提高其幼苗在低温条件下的存活率和抗冻性,从而证明CaM与植物的抗冻性相关[24]。因此,CaMBP的鉴定是研究CaM生理功能作用的重要手段。目前,已经鉴定了一系列参与逆境胁迫反应的CaMBP,如NAD激酶、一氧化氮合成酶、谷氨酸脱羧酶等[25]。研究证明,苹果钙调蛋白是抗褐斑病相关蛋白[15],关于其在苹果响应损伤、高温和低氧等非生物胁迫中的功能尚无相关报道。
本研究结果表明,MdCaM对不同胁迫的响应模式不同。损伤处理后,MdCaM迅速应答,其相对表达量在处理后6 h达到峰值,约为为对照组的5倍,24 h后渐恢复正常水平;在20,40 ℃ 2个高温逆境胁迫环境下,MdCaM均在胁迫早期被强烈诱导,且在处理后12 h左右达到峰值,随后表达水平小幅下调,但仍然显著高于对照组;MdCaM在无氧(0 O2)胁迫早期受到强烈诱导,在处理后1 h达到峰值,约为对照组的3倍,与无氧胁迫相比,低氧环境下(3%O2)MdCaM相对表达量上调幅度较小,应答较为迟缓,6 h后达到峰值,为对照组的2倍,后均恢复正常水平。从以上研究结果看,MdCaM基因受到损伤、高温、低氧等胁迫条件诱导,特别是在胁迫早期有明显应答。说明苹果MdCaM基因具有响应损伤、高温、低氧等非生物胁迫的能力,可能在适应胁迫环境的早期发挥重要作用。本研究为进一步利用现代分子生物学技术和植物遗传育种方法揭示MdCaM的功能及其网络调控机制奠定基础,为阐明苹果釆后抗逆生理机制及进一步利用该基因进行抗性育种提供重要参考依据。然而,MdCaM响应逆境胁迫的分子机制如何,有哪些下游靶蛋白参与其调控过程,其与下游靶蛋白相互作用的信号通路及调控网络等问题亟待进一步深入研究。
[1] Kudla J,Batistic O,Hashimoto K.Calcium signals:the lead currency of plant information processing[J]. Plant Cell, 2010, 22(3):541-563.
[2] Perochon A, Aldon D, Galaud J P, et al. Calmodulin and calmodulin-like proteins in plant calcium signaling[J]. Biochimie, 2011, 93(12):2048-2053.
[3] 苏丽艳,李正国,樊 晶,等.脐橙CsCAB基因的克隆及表达载体构建[J].华北农学报, 2010, 25(2):40-43.
[4] 易籽林,徐 立,黄绵佳,等.钙信号系统与植物激素信号的研究进展[J].中国农学通报, 2010, 26(15):221-226.
[5] Yang T, Poovaiah B. A calmodulin-binding/CGCG box DNA-binding protein family involved in multiple signaling pathways in plants[J]. The Journal of Biological Chemistry, 2002, 277(47):45049-45058.
[6] Ma L, Fan Q, Yu Z, et al. Does Aluminum inhibit pollen germination via extracellular calmodulin[ J]. Plant & Cell Physiology, 2000, 41(3):372-376.
[7] Zhang W, Zhou R G, Gao Y J, et al. Molecular and genetic evidence for the key role of AtCaM3 in Heat-Shock signal transduction in Arabidopsis[J]. Plant Physiology, 2009, 149(4):1773-1784.
[8] Xuan Y, Zhou S, Wang L, et al. Nitric oxide functions as a signal and acts upstream of AtCaM3 in thermotolerance in Arabidopsis seedlings[J]. Plant Physiology, 2010, 153(4):1895-1906.
[9] 杨廷良,崔国贤,罗中钦,等.钙与植物抗逆性研究进展[J].作物研究, 2004(5):380-384.
[10] Singh P, Virdi A S. Ca2+, Calmodulin and plant-specific calmodulin-binding proteins:implications in abiotic stress adaptation[M].New York:Springer New York,2013,1:1-23.
[11] Townley H, Knight M. Calmodulin as a potential negative regulator of Arabidopsis COR gene expression[J]. Plant Physiology, 2002, 128(4):1169-1172.
[12] 张和臣,尹伟伦,夏新莉.非生物逆境胁迫下植物钙信号转导的分子机制[J].植物学通报, 2007, 24(1):114-122.
[13] Zeng H, Xu L, Singh A, et al. Involvement of calmodulin and calmodulin-like proteins in plant responses to abiotic stresses[J]. Frontiers in Plant Science, 2015, 6(660):600.
[14] 程晓培,徐碧玉,刘菊华,等.香蕉钙调蛋白基因MaCAM在非生物胁迫下的表达分析[J].生命科学研究, 2013, 17(1):20-23.
[15] 周 倩.秦冠苹果抗褐斑病相关基因表达特性分析[D]. 西安:西北农林科技大学, 2012.
[16] Livak K J, Schmittgen T D. Analysis of relative gene expression data using Real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4):402-408.
[17] 曾后清, 张夏俊, 张亚仙,等. 植物类钙调素生理功能的研究进[J].中国科学: 生命科学, 2016, 46(6): 705-715.
[18] Das R, Pandey A, Pandey G K. Role of calcium/calmodulin in plant stress response and Signaling[M].New Delhi:Springer India,2014:53-84.
[19] Reddy A S, Ali G S, Celesnik H, et al. Coping with stresses:roles of calcium-and calcium/calmodulin-regulated gene expression[J]. Plant Cell, 2011, 23(6):2010-2032.
[20] Virdi A S, Singh S, Singh P. Abiotic stress responses in plants: roles of calmodulin-regulated proteins[J].Frontiers in Plant Science, 2015, 6(809): 1-19.
[21] 宋唯一,郑爱珍,张正斌,等.钙通道蛋白与植物抗盐性和抗冷性关系研究进展[J].西北植物学报, 2010, 30(11):2351-2357.
[22] 张晶晶,李金金,年洪娟.钙/钙调素信号途径在胁迫中的作用研究进展[J].中国微生态学杂志, 2013, 25(7):858-860.
[23] Yang T B, Poovaiah B W. Calcium/calmodulin-mediated signal network in plants[J].TRENDS in Plant Science, 2003, 8(10):505-512.
[24] 林善枝,李雪平,张志毅.在低温诱导毛白杨抗冻性中CaM含量和 G6PDHase及ATPase活性的变化[J].北京林业大学学报, 2001, 23(5):4-9.
[25] 毛国红,松林霞,孙大业.植物钙调蛋白结合蛋白研究进展[J].植物生理与分子生物学学报, 2004, 30(5):482-488.