大白菜干烧心病是我国近年来大白菜生产上继三大病害之后,危害较为严重的一种病害[1-2],是不可逆的生理病害之一,会造成严重的经济损失[3-4]。干烧心病经常和病原菌感染一起发生,进一步造成减产和品质下降[5]。干烧心病的成因极其复杂,现在人们普遍认为是由于钙离子的缺失引起的生理性病害[6-9]。此外,由于干烧心病是数量性状,受多基因控制,数量性状在选择中易受环境因素影响,因此成为育种工作的难点[10]。QTL定位与分子标记辅助选择育种显得尤为重要。国内外有关大白菜干烧心病方面的报道主要集中在发病机理[2]、症状表现[11]、栽培防治[12-14]、遗传规律[15]和室内鉴定方法[16-17]等方面的研究,有关大白菜干烧心病QTL定位的研究虽然有一些报道,但目前研究尚少。孙秀峰等[18]首次将大白菜干烧心病的研究深入到分子方面,以F2作为群体,构建了AFLP分子遗传图谱,利用 MAPQTL 4.0 软件检测到与抗干烧心病有关的QTL位点共有4个,解释的遗传变异为11%~58.9%。李坤等[19]以F2群体为材料,利用SSR、SRAP分子标记,对大白菜干烧心病性状相关的QTL与相应的连锁关系进行分析,获得2个与干烧心病性状相关的QTL,都位于LG2连锁群上,贡献率分别为7.8%和16.5% 。黄萍等[20]报道了1个与大白菜干烧心病基因紧密连锁的AFLP标记( E10/ M05),E10/M05与大白菜干烧心病感病性状是相连锁的,此标记与干烧心病病情级数的相关系数为0.633,达到极显著相关。石姜超[15]报道了2个与大白菜干烧心病基因连锁的SRAP分子标记,遗传距离分别为6.5,5.8 cM。对大白菜干烧心病性状进行QTL定位,以期利用与QTL紧密连锁的分子标记进行大白菜资源干烧心病抗性的辅助选择。
1 材料和方法
1.1 永久群体和图谱的构建
本研究材料黑227为青麻叶类型大白菜高代自交系,抗干烧心病;包头型高代自交系B120,感干烧心病,由天津科润蔬菜研究所提供。以黑227为父本、B120为母本配制杂交一代,通过游离小孢子培养的方法构建了含99个株系的DH群体为永久作图群体。以该群体为试材已绘制完成一张大白菜遗传图谱。该图谱含有108个标记位点(其中34个SSR标记,74个InDel标记),全长1 004.7 cM,平均图距9.30 cM,包含12个连锁群,其中可与大白菜9条染色体一一对应[21]。
1.2 试验设计
试验分别在2015年春季和2016年春季进行,2015年播种日期为1月29日,定植日期为3月5日,调查日期为5月7日;2016年播种日期为2月14日,定植日期为3月15日,调查日期为5月17日。试材种植在天津市宝坻区农业局农场日光温室中,各株系调查株数均为5株。种植密度为:行距50 cm,株距40 cm。常规栽培管理。
1.3 大白菜干烧心病的田间鉴定
春季在日光温室进行DH群体的种植,根据田间干烧心病发病程度对每个株系进行病害分级,群体病情分级标准如表1所示,抗性归类标准如表2所示,病情指数(DI) =∑(每个病级的植株总数×所归类的级别数)/(植株总数×最高级别数)×100。将病情指数进行整理,用SPSS软件对2年的结果进行统计,计算遗传参数并绘制频数分布直方图。
表1 大白菜干烧心病病情分级标准
Tab.1 The grade standards of tipburn
symptoms in Chinese cabbage

级别Degree症状Symptoms0植株正常1轻微干纸状3严重干纸状或轻微腐烂5中度腐烂7严重腐烂
表2 大白菜干烧心病抗性归类标准
Tab.2 The standard of resistance classification
in Chinese cabbage

抗性Resistance type病情指数Disease index高抗 Highly resistant病情指数≤15抗病 Resistant15<病情指数≤35耐病 Tolerant35<病情指数≤55感病 Susceptible55<病情指数≤80高感 Highly susceptible病情指数>80
1.4 大白菜干烧心病QTL定位
采用MapQTL 5.0进行QTL分析,首先使用置换测验做1 000次重复,用于估算大白菜基因组范围内α=0.05水平上的LOD阈值。本研究中2015年使用的LOD阈值为7.7,2016年使用的LOD阈值为2.8。然后利用区间作图法进行QTL分析,在每条染色体上每间隔1 cM的位置对QTL存在的可能性进行1次扫描。对于检测到的QTL位点,将最高的LOD值所在位置的分子标记或与其紧密连锁的分子标记作为协同因子,再对这些QTL位点进行多座位QTL模型检测,将LOD值最高的位置作为本试验QTL的位置,以2-LOD所在的区间作为95%的置信区间。QTL的命名规则为:干烧心性状的英文缩写+连锁群号+QTL编号。
使用复合区间作图法在大白菜全基因组范围内进行QTL扫描,用似然比LR大于11.5,即LOD值大于2.5来判断QTL存在的阈值。
1.5 QTL 定位区域的序列分析
使用NCBI中的Blast 功能将检测到的QTL 定位区域序列同大白菜全基因组序列进行比较,利用提供的基因注释功能对QTL 定位区域中的所有候选基因进行分析。
2 结果与分析
2.1 大白菜干烧心病的抗性鉴定结果与遗传分析
对本试验中2015,2016年的亲本、F1以及DH群体的抗病性进行调查,统计与分析的结果如表3所示。2015,2016年黑227的DI均为0,表现为高抗,B120 的 DI 分别为 82.14和85.71,表现为高感,F1的 DI 分别为16.67和15.43,介于2个亲本之间,并且趋于抗病。根据2个年度大白菜DH群体鉴定得到的DI结果,绘制频数分布直方图(图 1,2)。结果表明,本研究中所用DH群体2015年的DI结果不符合正态分布,而2016年该群体的DI结果服从正态分布,属于数量性状遗传,该群体可以用于QTL分析。
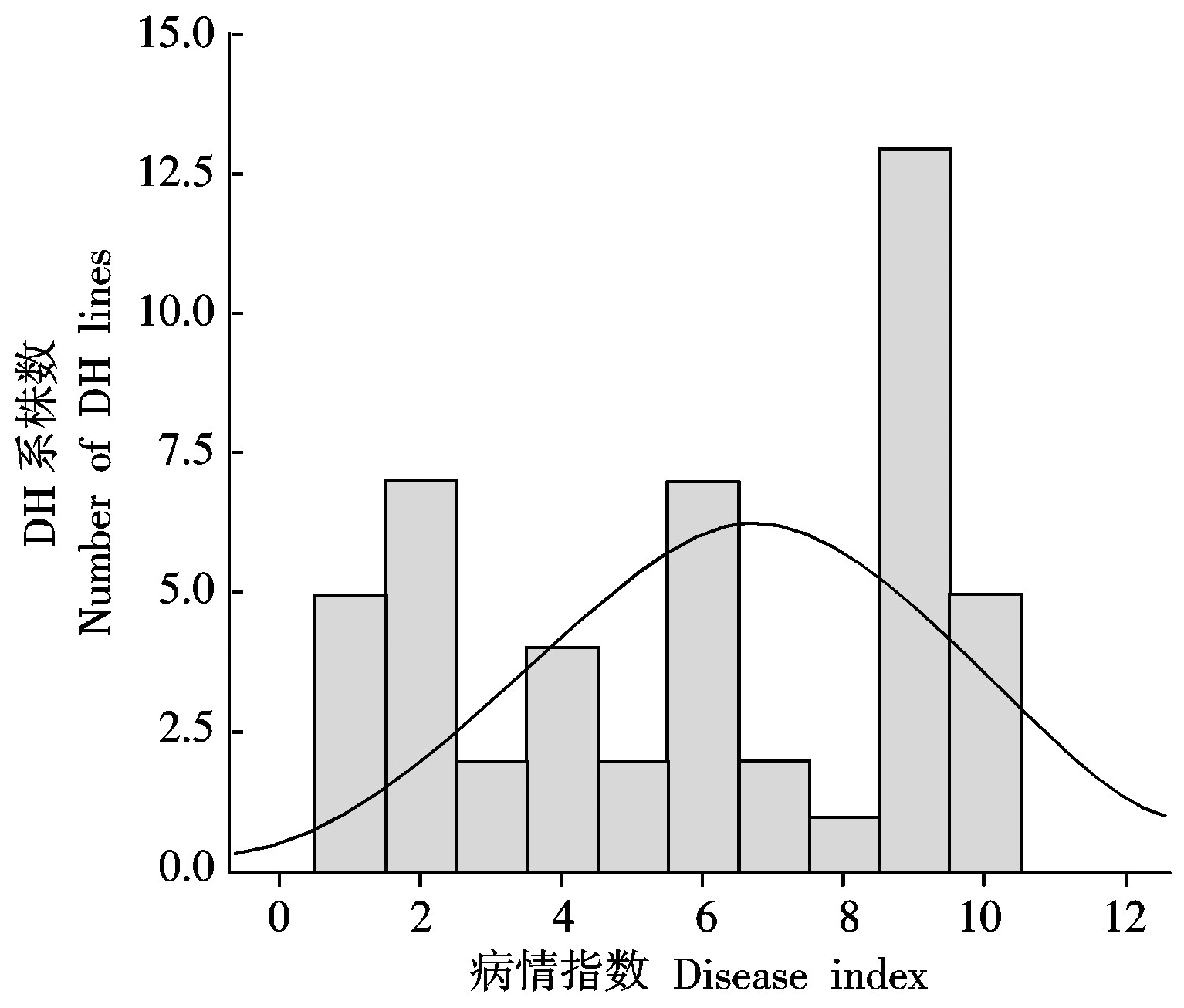
图1 2015年DH群体干烧心病病情指数的频数分布图
Fig.1 Frequency distributions of disease index oftipburn in DH populations in 2015
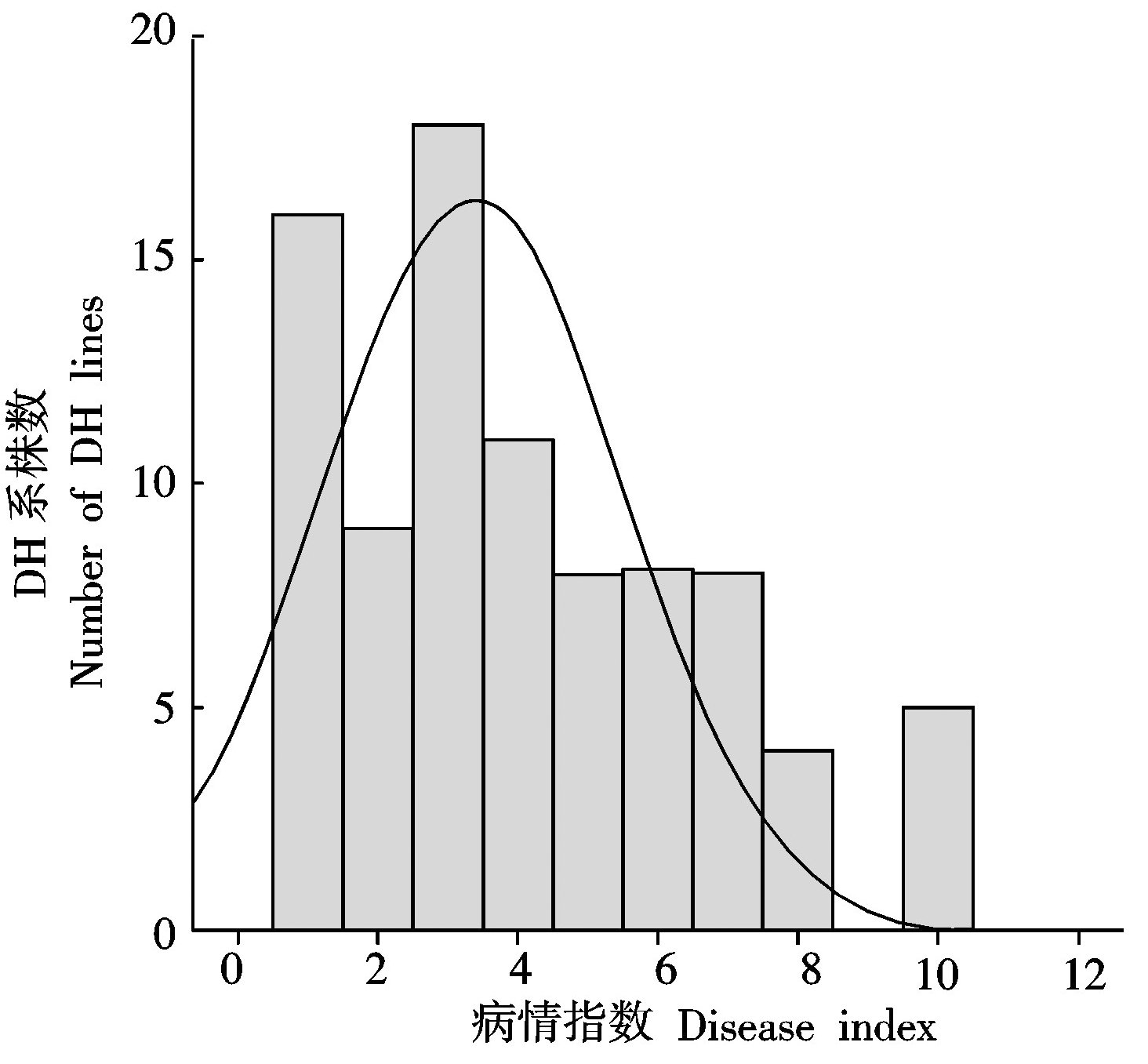
图2 2016年DH群体干烧心病病情指数的频数分布图
Fig.2 Frequency distributions of disease indexof tipburn in DH populations in 2016
2.2 大白菜干烧心病抗性基因的 QTL 定位
利用MapQTL 5.0软件进行QTL分析,2015,2016年连续2年的数据,对大白菜DH群体进行QTL定位,发现检测到的QTL位点一致,可以认为是相同的 QTL,因此给予了相同的命名tb7.1,2次结果的遗传贡献率均大于10%,为主效QTL,该QTL位于 Chr.7上(图3),其中BrID10343为共分离标记,BrID10349为紧密连锁标记,加性效应均为正值。
根据 2015年干烧心病抗性鉴定结果,tb7.1位于标记BrID10343和BrID10349之间,距离两侧标记的遗传距离分别为6.9,5.0 cM,2个标记的LOD 值分别为9.91,9.72,遗传贡献率分别为41.5%,41.1%,tb7.1为增效位点,加性效应为正值。根据 2016年干烧心病抗性鉴定结果,2个标记的LOD 值分别为4.46,4.10,遗传贡献率分别为19.6%,18.2% (表4)。
表3 亲本、F1的病情指数及DH群体的遗传参数
Tab.3 Disease index of parental lines and F1 and some genetic factors in DH populations
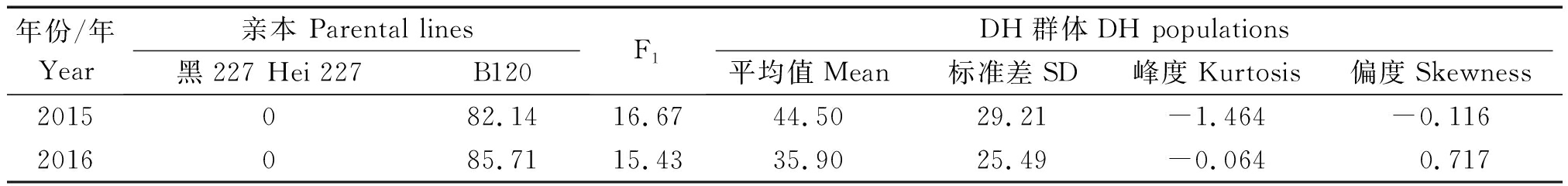
年份/年Year亲本 Parental lines黑227 Hei 227B120F1DH群体DH populations平均值Mean标准差SD峰度Kurtosis偏度Skewness2015082.1416.6744.5029.21-1.464-0.1162016085.7115.4335.9025.49-0.0640.717
表4 2015,2016年大白菜干烧心病抗性基因的 QTL 分析
Tab. 4 QTL analysis of tipburn resistance gene in Chinese cabbage in 2015 and 2016
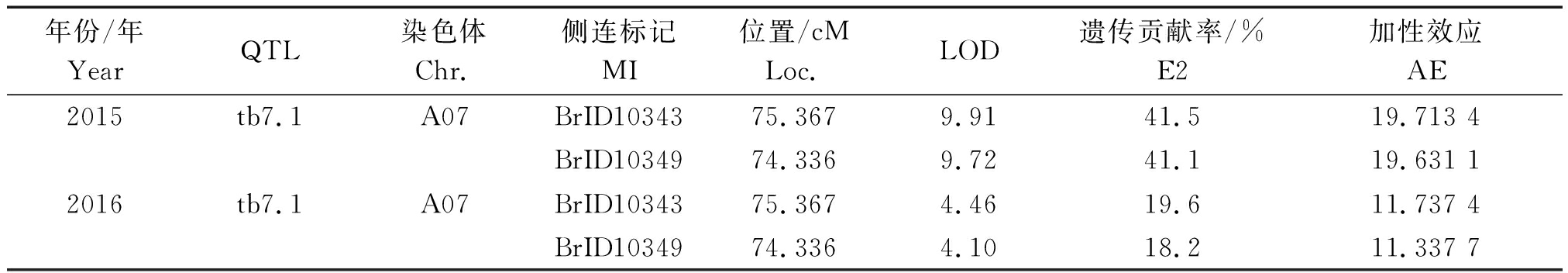
年份/年YearQTL染色体Chr.侧连标记MI位置/cMLoc.LOD遗传贡献率/%E2加性效应AE2015tb7.1A07BrID1034375.3679.9141.519.713 4BrID1034974.3369.7241.119.631 12016tb7.1A07BrID1034375.3674.4619.611.737 4BrID1034974.3364.1018.211.337 7
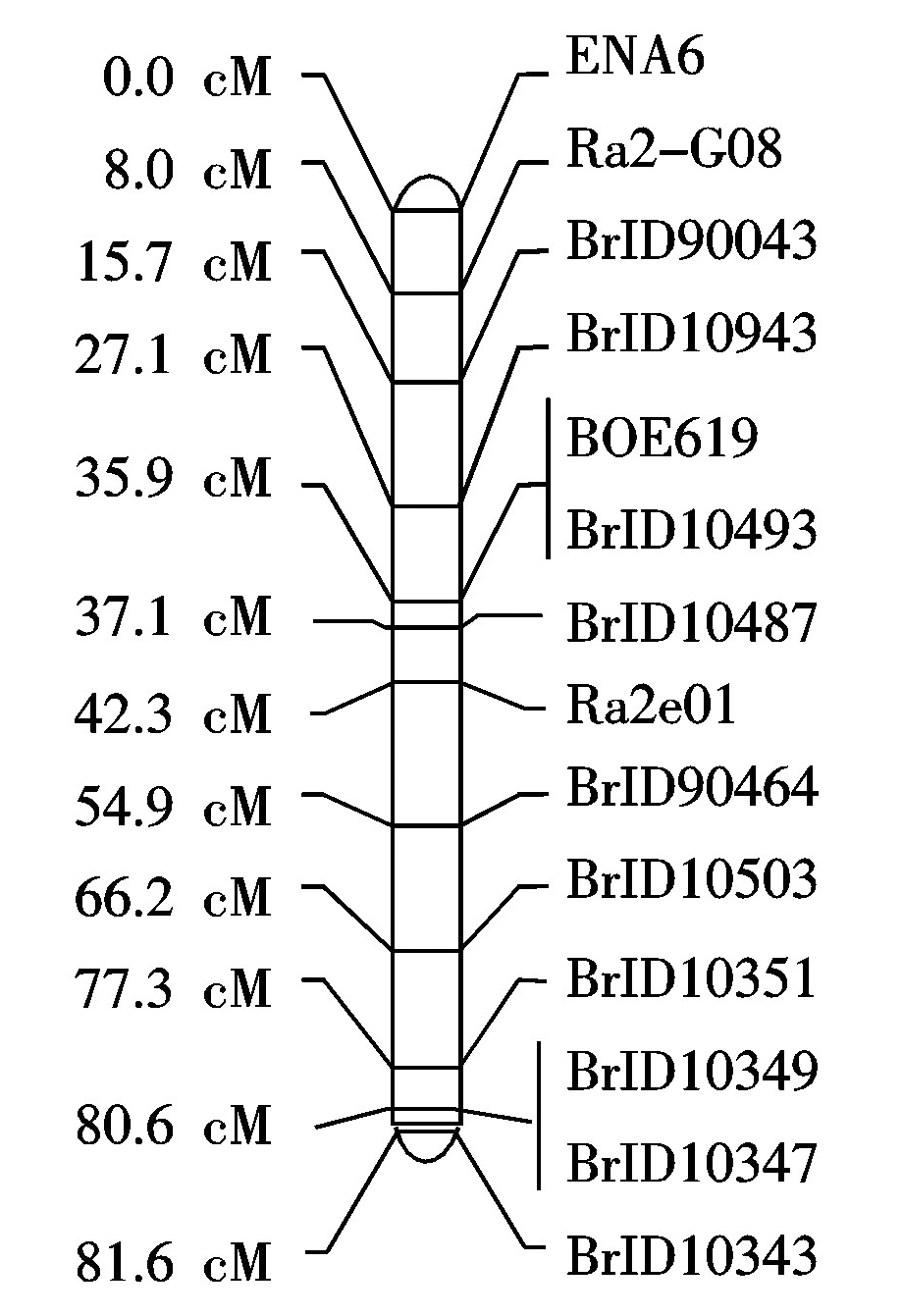
图3 大白菜Chr.7分子遗传图谱
Fig.3 Molecular genetic linkage mapof Chinese cabbage chromosome 7#
2.3 干烧心病抗性基因所在区域的生物信息学分析
利用BRAD (http:// brassicadb.org/brad/index.php)的BlastP工具获得与大白菜中相对应的拟南芥中的同源基因及基因注释功能,对大白菜干烧心病抗性基因QTL所在区域进行了序列分析,发现标记BrID10343和BrID10349间的物理距离为903.61 kb,在这两标记区间共有202个候选基因(图3)。这些候选基因主要分为以下几类:锌指结构、转运蛋白、酶类、转录因子以及3个 NBS 抗病基因(Bra016029、Bra016028、Bra016027)(表5),这些抗病候选基因是下一步工作的研究重点。
表 5 大白菜干烧心抗性基因的预测结果
Tab. 5 Results of tipburn resistance gene prediction in Chinese cabbage

大白菜基因编号Gene number of Chinese cabbage拟南芥基因编号Gene number of Arabidopsis thaliana注释功能FunctionBra015964AT1G73805结合钙调蛋白Bra015979AT1G73630钙结合蛋白Bra016027AT1G72890TIR-NBS抗性蛋白 Bra016028AT1G72950TIR-NBS抗性蛋白 Bra016029AT1G72890TIR-NBS抗性蛋白Bra016042AT1G72670结合钙调蛋白Bra016068AT1G72300富含亮氨酸的跨膜蛋白激酶Bra016069AT1G72300富含亮氨酸的跨膜蛋白激酶Bra016081AT1G72180富含亮氨酸的跨膜蛋白激酶
3 讨论
3.1 关于2015,2016年DH群体的参数分析
根据2015,2016年的数据,通过计算偏度g1和峰度g2及其标准误σg1及σg2然后作U检验。U检验公式为和。根据2015年的数据,0.116/0.343<1.96,1.464/0.674>1.96,该组资料不服从正态分布。根据2016年的数据,0.717/0.386<1.96,0.064/0.411<1.96,2种检验同时得出U
3.2 关于2015,2016年DH群体干烧心病病情指数分布的差异
2年的病情指数分布存在差异,可能有以下几个原因:①群体2年所处的自然环境存在差异,包括光照、水分、温度、湿度等,导致发病程度不一。②由于土地面积原因,每种材料种植的数量较少,应尽可能扩大样本容量,减少引起的抽样误差。③对于抗性鉴定的分级,受到笔者经验的影响,存在主观因素。但2年均定位到同一位点,并且LOD远远大于2.5,说明定位结果的可靠性。
3.3 关于大白菜干烧心病的分子标记
由于大白菜干烧心病的鉴定易受环境因素的影响,比较费时费力,研究者们主要利用MAS 育种选择抗病品种,以提高育种效率。然而,目前与大白菜干烧心病抗性基因紧密连锁的分子标记报道较少,且大多为 SRAP和AFLP标记,由于这些标记的连锁距离不够紧密,加上 SRAP 和AFLP技术的局限性,导致前人研究结果对于MAS育种的应用性不强。
本研究首次利用InDel标记对大白菜干烧心性状进行了定位,相较于孙秀峰等[22]和黄萍等[20]利用的AFLP标记,李坤等[19]和石姜超等[11]利用的SRAP标记、InDel标记具有许多优点,它广泛存在于基因组中,并且稳定性高,重复性好,易于操作,多态性水平高[23]。InDel标记的开发,对基因精细定位的研究和分子标记辅助育种具有重要的价值。
3.4 关于大白菜干烧心病抗性基因的QTL定位
目前,大白菜干烧心QTL的定位只是在各自构建的连锁群上,没有实现与染色体的对应,彼此之间的 QTL 也很难进行比较分析。本研究首次利用DH群体将大白菜干烧心病抗性QTL 定位到了大白菜染色体上。笔者尝试将本研究QTL 定位的结果与前人的结果进行对比分析,但由于没有发现共用的分子标记,所以无法进行比较。
QTL定位是采用田间试验与分子标记分析相结合的方法进行的,因此它是连接作物遗传和育种的纽带。与大白菜干烧心基因紧密连锁的分子标记的开发为大白菜主要经济性状分子标记辅助选择提供了理论基础。
3.5 关于大白菜干烧心病抗性基因主效 QTL 的生物信息学分析
在大白菜干烧心病抗性基因主效QTL所在区域预测到了3个抗病基因 Bra016029、Bra016028、Bra016027,这些基因将是今后研究的重点。
[1] 吉雪花, 张鲁刚, 张少丽.叶片扦插法鉴定大白菜耐低钙性的研究初报[J].西北农林科技大学学报:自然科学版,2005,33(8):99-102.
[2] 张 鹤, 赵 熙, 刘 莉.大白菜干烧心病的研究进展[J].天津农业科学,2009,15(6):47-48.
[3] Nieuwhof M.Internal tipburn in white cabbage Ⅰ. Variety trials[J].Euphytica,1960,9(2):203-208.
[4] Bradfield E G, Guttridge C G.The dependence of calcium transport and leaf tipburn in strawberry on relative humidity and nutrient solution concentration[J].Annals of Botany,1979,43(3):363-372.
[5] Su T, Yu S, Yu R, et al.Effects of endogenous salicylic acid during calcium deficiency-induced tipburn in Chinese cabbage(Brassica rapa L. ssp. pekinensis )[J].Plant Molecular Biology Reporter,2015, 34(3):607-617.
[6] 安志信, 鞠珮华, 苏幼梅, 等.大白菜干烧心病的发生和心叶补钙效果的研究[J]. 中国蔬菜,1985,1(2):5-10.
[7] Aloni B, Pashkar T, Libel R.The possible involvement of gibberellins and calcium in tipburn of Chinese cabbage:Study of intact plants and detached leaves[J].Plant Growth Regulation,1986,4(1):3-11.
[8] LIM C H O,Adams P.Effects of diurnal changes in the salinity of the nutrient solution on the accumulation of calcium by tomato fruit[J].Annals of Botany,1989,64(4):373-382.
[9] Francois L E, Donovan T J, Maas E V.Calcium deficiency of artichoke buds in relation to salinity[J].Hortscience,1991,26(5):549-553.
[10] Collard B.An introduction to markers, quantitative trait loci (QTL) mapping and marker-assisted selection for crop improvement:The basic concepts [J].Euphytica,2005,142(1-2):169-196.
[11] 石姜超,段岩娇,张鲁刚.大白菜干烧心病病状特征与抗性遗传规律[J].西北农业学报,2012,21(10):106-112.
[12] 杨俊霞. 大白菜干心病防治技术[J]. 现代农业,2016(2):24-24.
[13] 赵美华, 巫东堂, 赵军良. 早秋大白菜优质丰产栽培技术[J]. 长江蔬菜,2016(14):50-51.
[14] 陈则明. 秋季大白菜优质栽培技术[J]. 天津农林科技,2015(3):24-25.
[15] 石姜超.大白菜干烧心病抗性遗传与分子标记[D].杨凌:西北农林科技大学,2012.
[16] 黄 萍. 大白菜干烧心病苗期鉴定方法和AFLP标记筛选的研究[D].杭州:浙江师范大学,2011.
[17] 张 鹤, 路翠玲, 刘国栋,等. 6个大白菜品种干烧心病苗期鉴定[J]. 安徽农业科学,2016(12):162-163.
[18] 孙秀峰,陈振德,李德全.利用大白菜抗感干烧心病F2群体构建AFLP遗传连锁图[J].分子植物育种,2006(1):65-70.
[19] 李 坤,史庆馨,张耀伟.与大白菜干烧边性状相关的SSR和SRAP标记分析[J].中国瓜菜,2010,23(4):6-11.
[20] 黄 萍,王五宏,李必元,等.大白菜干烧心病基因AFLP分子标记的研究[J].浙江农业科学,2011,1(5):991-994.
[21] 刘俊峰,张 斌,李 梅,等.利用DH群体构建大白菜分子遗传图谱[J].华北农学报,2015,30(2):156-160.
[22] 孙秀峰,陈振德,李德全.大白菜干烧心病性状的QTL定位和分析[J].分子植物育种,2008,6(4):702-708.
[23] 于拴仓,王永健,郑晓鹰.大白菜分子遗传图谱的构建与分析[J].中国农业科学,2003,36(2):190-195.