通过调控植物的光合作用来增加植物的产量,是继通过传统育种技术、栽培措施及农业实践等方法后,实现植物产量增加的一个新的重要的方向[1]。在大多数植物中,卡尔文循环在植物碳代谢中占据重要位置,调控这个途径对于提高植物的光合效率和产量意义重大。
Rubisco作为卡尔文循环中的关键酶,不仅可以催化2个具有竞争性的反应,同时它也是一个具有较低周转次数的低效酶,它的有效活化需要Rubisco活化酶(RCA)的参与[2]。因此,对RCA基因的研究已成为近年来提高植物产量的一个新的重要目标。通过调控RCA基因的表达来增加Rubisco的活性,在改善植物光合效率和提高植物产量方面具有很大的潜力[3-4]。许多研究发现,RCA基因的表达受光、植物激素、组织特异性及昼夜模式的调控[5-8]。与RCA基因具有组织特异性和受光调控的转录模式一致,菠菜[9]、拟南芥[10]、马铃薯[11]和水稻[12]的RCA基因启动子在高等植物的绿色组织及光诱导下具有活性。RCA基因启动子的光诱导和组织特异性在应对叶食害虫或叶片抗病植物基因工程方面具有特定的优势。例如,在马铃薯基因工程方面,马铃薯的RCA基因启动子可用于表达只在植物绿色组织表达的防御基因来特异性的防御白粉病或者蚜虫[11]。因此,研究植物RCA基因的启动子,不仅有助于了解该基因的表达模式及调控机制,而且对于农业生产也具有重要意义。
启动子是影响基因表达效率的重要因子,其顺式作用元件决定了基因的表达量及表达模式[13]。启动子区的顺式作用元件可以响应光、植物激素、逆境胁迫和生物钟等,从而调控下游基因的表达。对启动子区进行顺式作用元件分析,有助于了解下游基因的表达模式及调控机制。棉花作为重要的经济作物,在农业生产中具有重要地位。目前,关于棉花RCA基因的研究主要集中在结构、活性和热胁迫条件下的蛋白表达等方面[14-15],关于其转录调控的分子机制研究很少。为此,本研究利用棉花基因组测序结果,以陆地棉品种百棉1号为材料,通过PCR方法从基因组中扩增GhRCAα启动子序列,并利用PlantCARE对其顺式作用元件进行分析。同时为了验证该启动子的功能,利用荧光定量PCR技术研究了该基因的表达特性,并通过瞬时表达的方法进一步研究其活性。旨在摸清RCA表达调控的分子机制,从而为提高棉花光合速率和产量提供理论基础。
1 材料和方法
1.1 供试材料
用于GhRCAα启动子克隆或组织表达模式分析的材料为陆地棉品种百棉1号,该材料由河南科技学院棉花研究所提供,于2015年4月20日种植于河南科技学院乔谢试验田。在幼苗期,当第3复叶完全展开时,取完全展开叶并立即速冻于液氮中,用于基因组DNA的提取。在盛花期取棉花植株的根、茎、叶和花(花瓣和萼片)及初铃期的铃壳和纤维用于棉花GhRCAα的组织表达模式分析。
1.2 DNA的提取及GhRCAα启动子的扩增
使用基因组DNA提取试剂盒(TIANGEN, China, DP321)提取百棉1号叶片DNA。以基因组DNA为模板进行GhRCAα启动子序列的扩增。引物序列为:GhRCAα-Promoter-F:5′- TCAGGGTATCTTCAGGGGTA-3; GhRCAα-Promoter-R:5′-GTCCTTTTCGGTCTGTGTCT-3′。
GhRCAα启动子扩增采用50 μL反应体系,包括:10 μL 5×PrimeSTAR GXL Buffer (Mg2+ plus),4.0 μL 2.5 mmol/L dNTPs,1.5 μL 10 mmol/L正反向引物,1 μL 1.2 U/μL PrimeSTAR GXL DNA Polymerase (TaKaRa, Japan),4.0 μL DNA模板及28.0 μL ddH2O。PCR反应程序:94 ℃ 2 min;98 ℃ 20 s, 61 ℃ 2.5 min, 共35个循环;最后4 ℃保温10 min。PCR扩增产物经1%的琼脂糖凝胶电泳分离检测,根据比对Marker条带,鉴定为目的基因的PCR产物经胶回收试剂盒(Axygen, China, AP-GX-4)纯化后送深圳华大公司测序。
1.3 序列分析
利用植物顺式作用元件数据库PlantCARE(http://bioinformatics.psb.ugent.be/webtools /plantcare/html/)[16]在线预测分析所克隆序列的顺式作用元件。
1.4 RNA 的提取和cDNA的合成
使用RNA提取试剂盒(BioFLUX, BSC65S1B),对所取样品进行总RNA提取。再用1%琼脂糖凝胶电泳确定RNA质量,而后RNA储存于- 80 ℃备用。使用TaKaRa反转录试剂盒对约2 μg RNA进行反转录,生成cDNA。反转录生成的cDNA采用棉花内参基因Actin检测质量,并保存于-20 ℃。
1.5 基因表达量测定
以反转录得到的各组织cDNA为模板,以棉花Actin基因为内参,进行荧光定量PCR分析。棉花GhRCAα和Actin基因的特异性荧光定量PCR引物分别为:QGhRCAα-F:5′-AGCCGCCGACATAATCAAAAAG-3′; QGhRCAα-R:5′-ACGGATGAGAGGAGCATACA GT-3′; QActin-F:5′-ATCCTCCGTCTTGACCTTG-3′; QActin-R:5′-TGTCCGTCAGGCAACTCAT-3′。
荧光定量PCR扩增体系(20 μL):2 × SYBR Premix Ex Taq(TaKaRa) 10 μL,正反引物各1 μL,模板cDNA 2 μL,ddH2O 6 μL。每个样品设置3个重复。扩增反应在Bio-rad Chromo4荧光定量PCR仪上运行,扩增条件为95 ℃ 2 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,40 个循环。采用2 -ΔΔCt 法分析数据,确定基因的相对表达量。
1.6 载体的构建及农杆菌介导的转化
已克隆的2 000 bp启动子片段通过载体相应的酶切位点(EcoRⅠ和PstⅠ)连入含有GUS报告基因的双元载体pCAMBIA1381Z(Cambia, Australia)中。构建好的双元载体(GhRCAα∷GUS)以及载体pCAMBIA1301(阳性对照:CaMV35S∷GUS)和pCAMBIA1381Z(阴性对照:无启动子)分别转化至根癌农杆菌菌株EHA105中,并通过农杆菌介导烟草转化的方法进行遗传转化。
1.7 组织化学染色
GUS活性检测参照Jefferson等[17]的方法并略加修改。取待检测的植物组织,加入GUS染色液,37 ℃温育过夜24 h。接着,用体积分数为70%,80%,90%,100%的乙醇系列进行脱色。最后,在体式显微镜下观察组织的染色情况并拍照。
2 结果与分析
2.1 GhRCAα启动子的克隆
以已克隆出的陆地棉GhRCAα cDNA序列(GenBank 登录号:AF329935)为查询序列BlastN陆地棉全基因组[18],得到起始密码子ATG上游2 000 bp调控序列,然后根据该序列设计引物,在百棉1号DNA(图1-A)中扩增GhRCAα启动子。GhRCAα的理论大小为2 309 bp,所得片段电泳结果显示,与预期的片段大小相符(图1-B)。经Blast比对确认,该片段为GhRCAα启动子序列。
2.2 GhRCAα启动子的序列分析
将分离获得的棉花GhRCAα ATG上游2 000 bp的启动子序列提交到启动子预测网站plantCARE在线分析启动子区的顺式作用元件组成。结果表明,许多重要的顺式作用元件,包括TATA-box、 HSE、 G-box、5UTR Py-rich和ciradian等特异地存在于GhRCAα启动子区(图2),且不同顺式作用元件的拷贝数也存在很大差异(表1)。进一步分析表明,这些顺式作用元件主要分为以下6类(表1)。第1类是光响应元件,包括G-box、I-box和GT1-motif等可能参与GhRCAα光调控的顺式作用元件;第2类是生物钟调控元件ciradian,该元件可能参与GhRCAα的昼夜表达模式调控;第3类是与植物激素响应有关的GARE-motif和ABRE元件,表明GhRCAa的表达可能受植物激素的调节;第4类是与逆境响应有关的元件,包括响应干旱胁迫的MBS元件,热激响应元件HSE等;第5类是基础表达相关的元件,包括CAAT-box (与增强转录效率有关)和TATA-box等,说明GhRCAα启动子是一个典型的由RNA 聚合酶Ⅱ结合的启动子;第6类是包括CGTCA-motif、TGACG-motif、as1、Skn-1_motif以及CAT-box等其他类顺式作用元件,其中as1具有参与根特异性表达的功能,CGTCA-motif和TGACG-motif具有参与茉莉酸响应的功能。以上这些结果表明GhRCAα的表达可能受光、生物钟、逆境及植物激素等的调控。
2.3 GhRCAα表达模式的分析
由于GhRCAα启动子区包含许多响应光、特定组织或生物钟的顺式作用元件,为了摸清这些元件的存在对GhRCAα表达有何影响,采用荧光定量PCR方法来研究GhRCAα在棉花不同组织中的表达情况。结果表明:GhRCAα在叶片中大量表达,而叶片是光合作用进行的主要位置,在纤维、茎、萼片、根、花瓣和铃壳中表达量很低(图3)。先前对棉花GhRCAα进行昼夜表达模式分析发现,GhRCAα基因的表达具有昼夜节律性,在光周期开始后1 h表达量最高,午夜表达量最低[15]。这些结果表明,GhRCAα的表达具有组织特异性且受昼夜模式的影响。该结果与启动子区的顺式作用元件分析结果相一致。
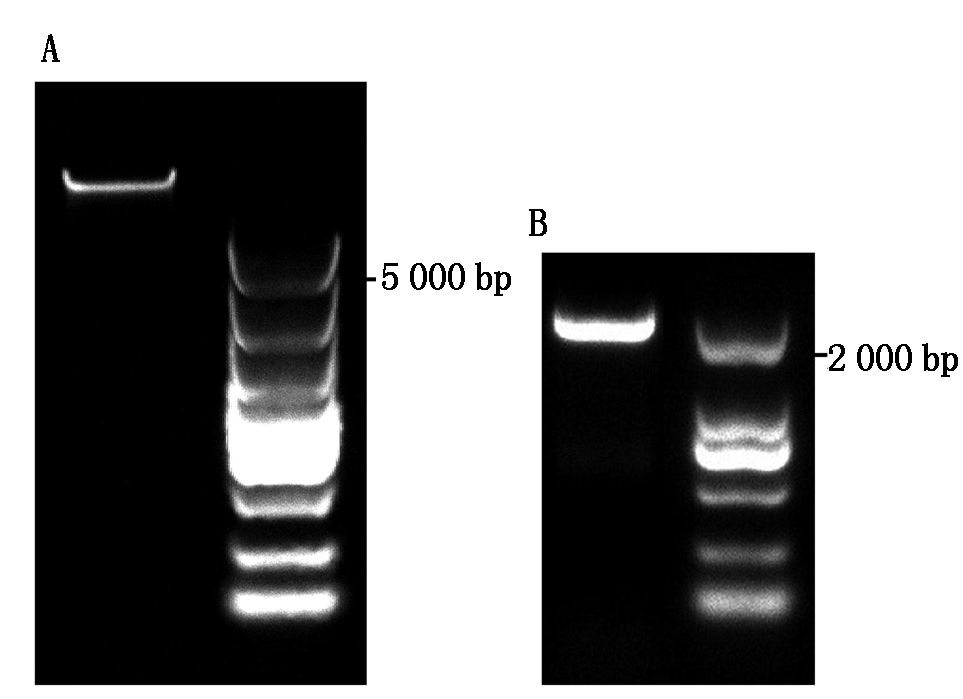
图1 棉花基因组DNA的提取(A)及GhRCAα启动子序列的扩增(B)
Fig. 1 The extraction of genomic DNA (A) and the PCR amplification (B) of GhRCAα promoter in cotton

ATG上游的2 000 bp片段定义为启动子区域,部分预测的顺式作用元件在图中用灰色阴影表示;
核苷酸的+1位置指的是起始密码子ATG中的A位置。
A 2 000 bp fragment upstream of the ATG start codon of GhRCAα was designated as the promoter region,
Parts of the putative cis-regulatory elements were noted under the sequences in shadow letters; The nucleotide at position +1 was the ATG start codon.
图2 GhRCAα 启动子的序列分析
Fig.2 Sequence analysis of the GhRCAα promoter in cotton
表1 GhRCAα启动子区包含的顺式作用元件
Tab.1 Cis-acting elements in promoter of GhRCAα
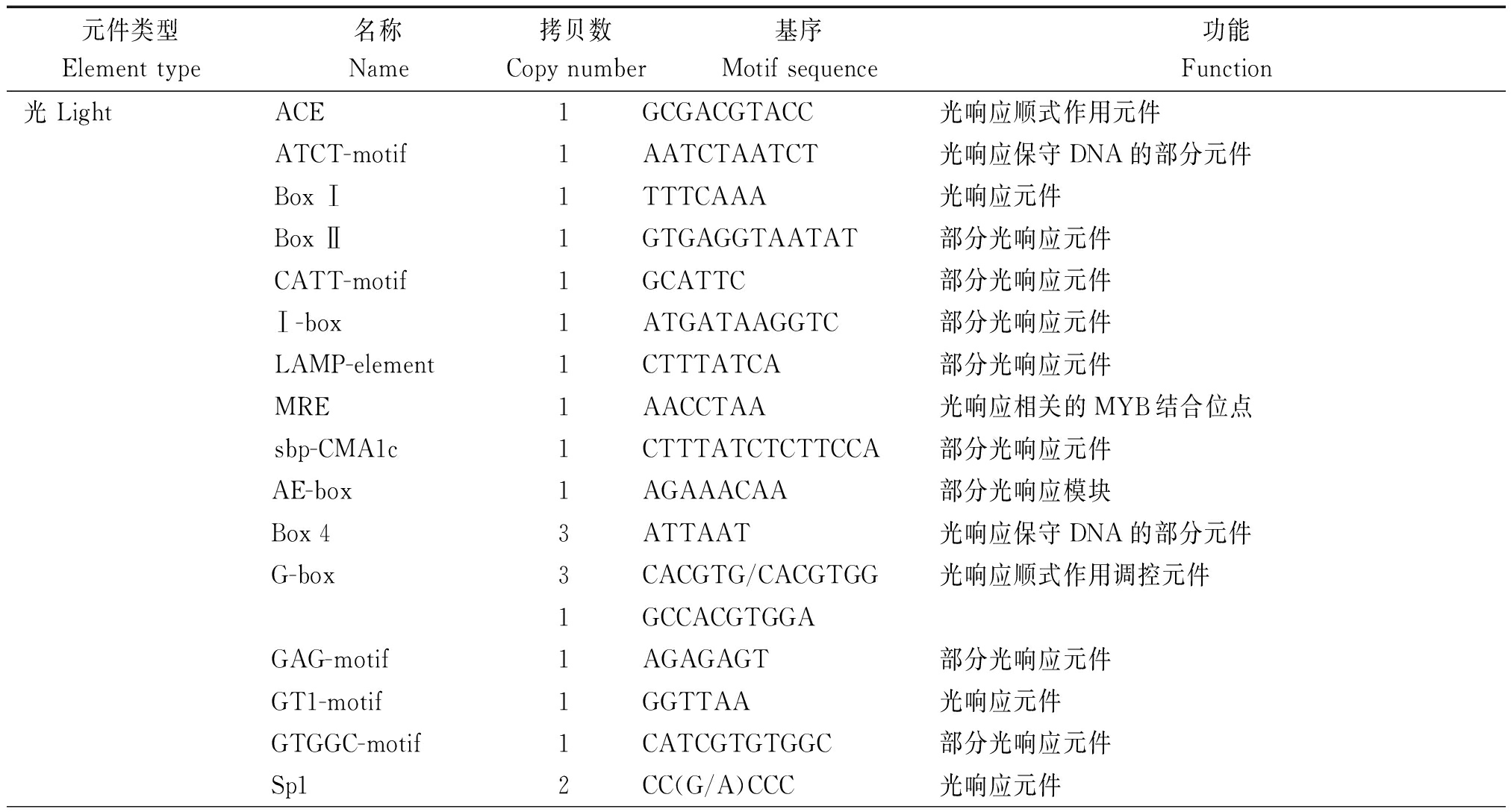
元件类型Element type名称Name拷贝数Copy number基序Motif sequence功能Function光 LightACE1GCGACGTACC光响应顺式作用元件ATCT-motif1AATCTAATCT光响应保守DNA的部分元件Box Ⅰ1TTTCAAA光响应元件Box Ⅱ1GTGAGGTAATAT部分光响应元件CATT-motif1GCATTC部分光响应元件Ⅰ-box1ATGATAAGGTC部分光响应元件LAMP-element1CTTTATCA部分光响应元件MRE1AACCTAA光响应相关的MYB结合位点sbp-CMA1c1CTTTATCTCTTCCA部分光响应元件AE-box1AGAAACAA部分光响应模块Box 43ATTAAT光响应保守DNA的部分元件G-box3CACGTG/CACGTGG光响应顺式作用调控元件1GCCACGTGGAGAG-motif1AGAGAGT部分光响应元件GT1-motif1GGTTAA光响应元件GTGGC-motif1CATCGTGTGGC部分光响应元件Sp12CC(G/A)CCC光响应元件
表1(续)

元件类型Element type名称Name拷贝数Copy number基序Motif sequence功能FunctionTCCC-motif1TCTCCCT部分光响应元件box Ⅱ1TCCACGTGGC部分光响应元件chs-CMA2a1GCAATTCC部分光响应元件生物钟Circadian circadian1CTAGCCCAAC昼夜节律顺式作用调控元件植物激素GARE-motif 1TCTGTTG赤霉素响应元件PhytohormoneABRE2ACGTGGC/CACGTG脱落酸响应顺式作用元件胁迫StressBox-W11TTGACC真菌诱导子响应元件ARE2TGGTTT厌氧诱导必需的顺式作用调控元件HSE1AAAAAATTTC热胁迫响应顺式作用元件MBS1CAACTG干旱诱导相关的MYB结合位点TC-rich repeats1ATTTTCTTCA防卫和胁迫响应顺式作用元件基础元件TATA-box17ATATAA/TAATA转录起始位点-30核心启动子元件Base element 14TATA/TATACA17TTTTA/TATATGT3TAAAAATAA/TATA-AA1TCTATAAATA1TATATTTATATTT3TATAA/TATAAAT1TCTATAAATT2ATTATA/TATTTA-AA5UTR Py-rich stretch2TTTCTTCTCT高转录水平顺式作用元件CAAT-box39CAAT/CAATT启动子和增强子区的一般顺式作用元件20CAAAT/CCAAT1TGCCAAC其他OtherATGCAAAT motif1ATACAAATTGAGTCA基序相关的顺式作用调控元件CGTCA-motif5CGTCA茉莉酸甲酯响应顺式作用调控元件O2-site1GATGACATGA醇溶蛋白代谢有关的顺式作用调控元件Skn-1_motif6GTCAT胚乳表达相关顺式调控元件TGACG-motif5TGACG茉莉酸甲酯响应顺式作用调控元件as11TGACGTCA根特异表达顺式作用调控元件CAT-box1GCCACT分生组织表达相关顺式作用元件 ELI-box31AAACCAATT激发子响应元件
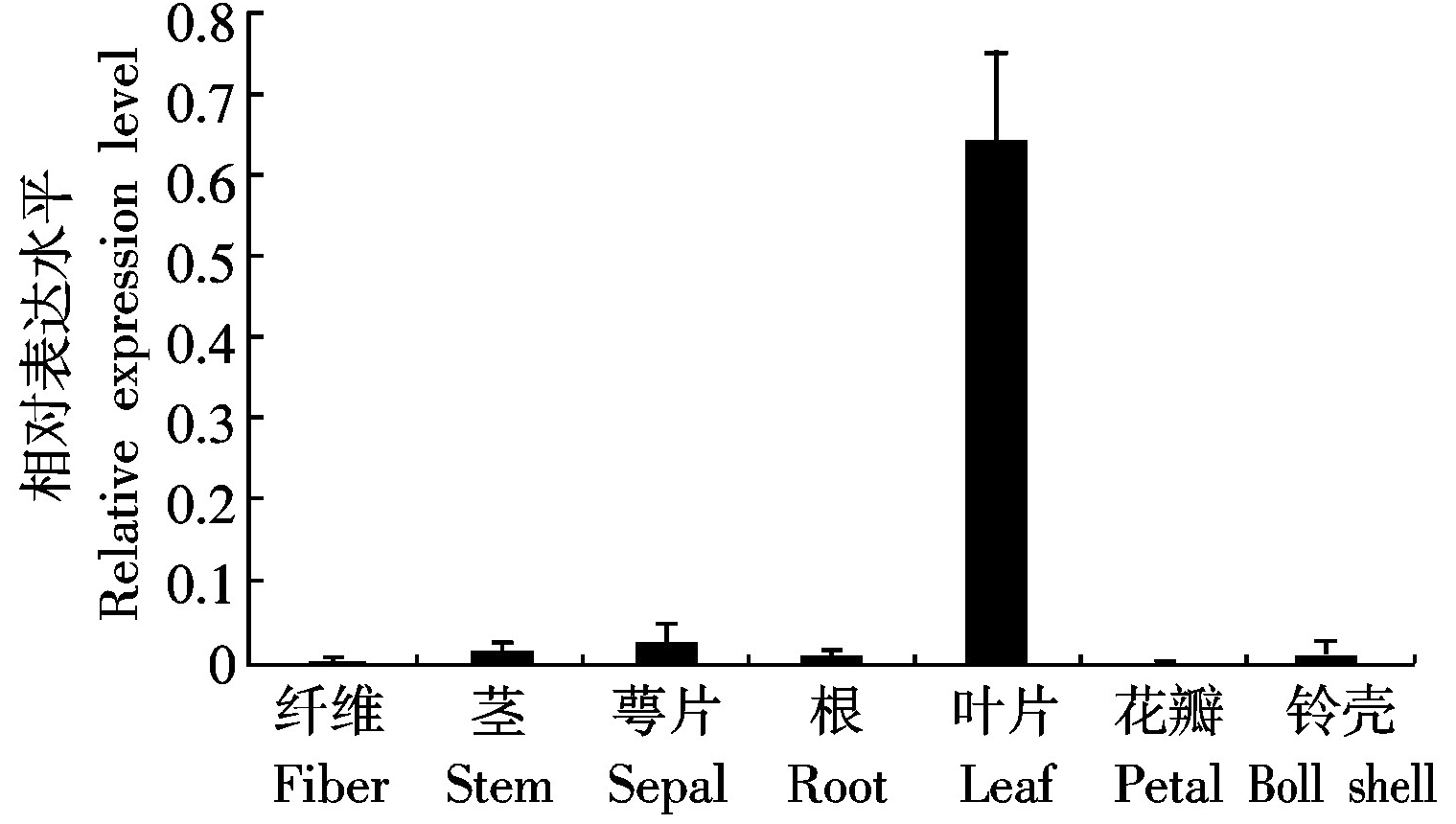
图3 棉花 GhRCAα的组织特异性表达分析
Fig. 3 Analysis of organ-specific expression of GhRCAα in cotton
2.4 植物表达载体的构建及活性分析
将克隆的2 000 bp的片段,用双酶切法连接到植物表达载体pCAMBIA1381Z。对重组质粒进行双酶切鉴定,得到1条约为2 000 bp的特异性条带(图4),与预期片段一致,表明已成功构建了由该启动子驱动报告基因GUS的植物表达载体(GhRCAα∷GUS)。
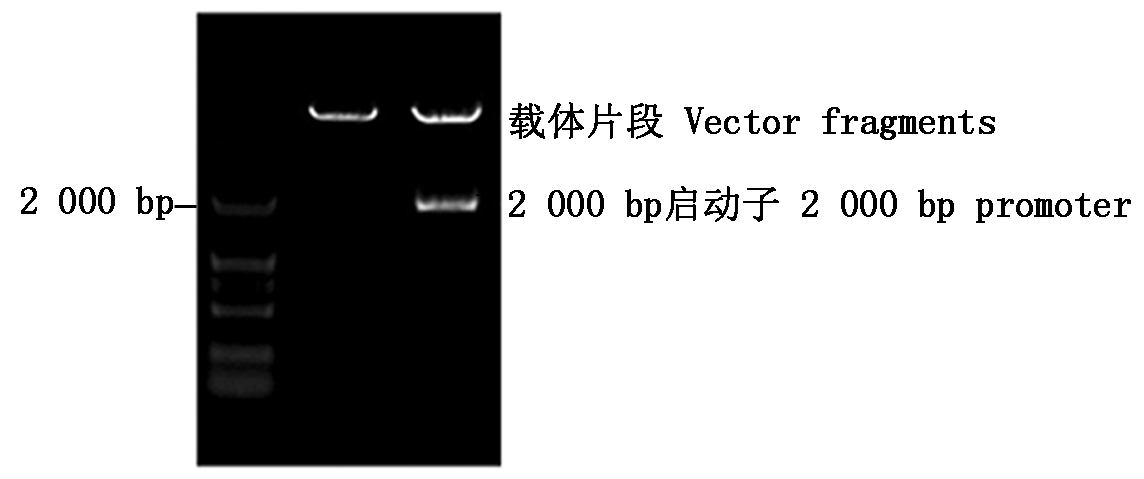
图4 表达载体GhRCAα∷GUS 的酶切分析
Fig.4 Restriction analysis of GhRCAα∷GUS vector
将重组表达载体(GhRCAα∷GUS)、pCAMBIA1301(阳性对照,CaMV35S∷GUS)以及pCAMBIA1381Z(阴性对照),通过农杆菌介导的烟草遗传转化进行瞬时表达。结果表明,阳性对照CaMV35S 启动子(图5-A)以及重组载体GhRCAα∷GUS(图5-B)转化的烟草叶片均能检测到GUS的表达产物,但是与阳性对照(CaMV35S 启动子)相比,目的载体染色弱于阳性对照,表明其活性比CaMV35S启动子低;pCAMBIA1381Z 载体没有启动子来驱动GUS的表达,所以检测不到GUS表达(图5-C)。这些结果表明,本研究克隆的GhRCAα启动子能够驱动下游基因GUS的表达,具有驱动目标基因表达的活性。
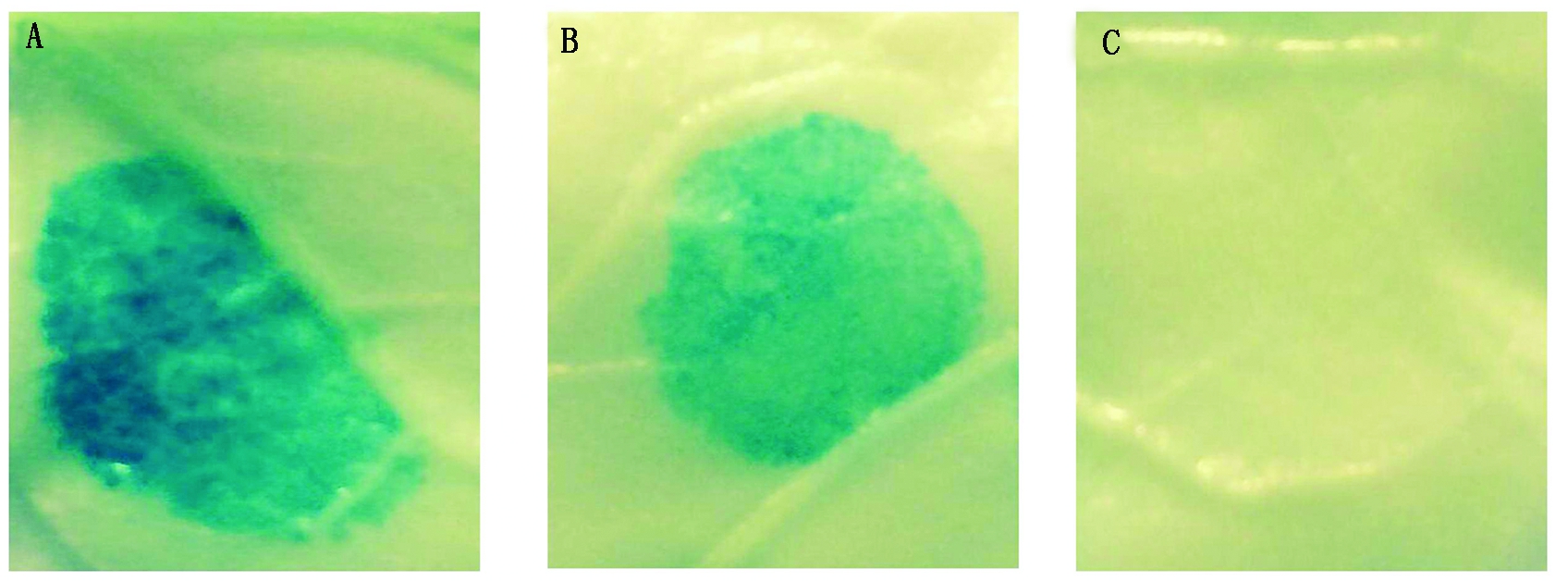
A.35S启动子; B.GhRCAα启动子;C.不含启动子的对照。
A.CaMV 35S promoter;B.GhRCAα promoter;C.Promoterless control.
图5 GhRCAα启动子片段驱动GUS基因在烟草叶片中的表达情况
Fig.5 Histochemical staining of tobacco leave driven by the promoter of GhRCAα
3 结论与讨论
启动子是决定外源基因在受体植物中转录效率高低的关键因子,合适的启动子将会促进外源基因的高效表达[19]。组成型启动子能使外源基因在受体植物中高效、持续的表达,但在特定时间或特定组织部位的表达达不到预期效果[20]。因此,诱导型或特异型启动子的研究越来越受到广大研究者们的青睐,发掘一种组织特异型或诱导型启动子对于转基因作物育种具有重要意义[21-23]。RCA基因作为光合作用过程中的一个关键基因,其表达除了受光诱导和昼夜模式的影响以外,还具有组织特异性,且受发育时期和植物激素的影响[5-8]。与其表达模式相一致,RCA启动子在高等植物的绿色组织及光诱导下具有活性,可作为一种组织特异型和诱导型启动子[9-11]。因此,克隆植物RCA基因的启动子,明确其组织特异性表达,可为转基因育种提供一种组织特异型或诱导型启动子。
近年来,关于棉花RCA基因启动子的克隆及功能研究很少,而关于RCA的结构、活性和蛋白表达已开展很多研究[14-15,24]。本研究对棉花GhRCAα启动子进行克隆及顺式作用元件分析表明,GhRCAα启动子除了具有基本的调控元件,还包含许多与光、生物钟、植物激素以及逆境响应有关的调控元件,这些元件特异地存在于GhRCAα启动区,并在拷贝数上存在很大差异。已有报道表明,启动子诱导表达的强度主要依赖于顺式作用元件的拷贝数,更具体的来说就是顺式作用元件相对于TATA-box的间距[25-26]。对大豆的RCA研究表明,重要启动子元件如G-box和pyrimidine-rich 5′-UTR在拷贝数目上的差异可能是导致GmRCAα和GmRCAβ表达量差异的一个原因[3]。棉花中GhRCAα启动子区这些重要顺式调控元件拷贝数变异可能参与了调控下游基因GhRCAα表达的强度及模式,但是关于其影响GhRCAα表达的分子机制还不清楚,在今后的研究中仍需进一步实验验证。
利用荧光定量PCR对GhRCAα表达特性进行分析表明,GhRCAα在棉花的不同组织表达量存在很大差异,在光合作用进行的主要位置叶片中表达量最高,其他组织表达量很低,其表达具有组织特异性。与此相一致的是大量光响应元件(G-box、ACE及I-box等),组织特异表达元件(as1等)特异地存在于GhRCAα启动子区。已有研究表明,植物的组织特异性表达可能是来源于根特异性表达元件的负调控,也可能是来源于叶特异性表达元件的正调控[10,27-28]。GhRCAα启动子区根特异性表达元件as1的存在可能是作为一个负调控元件参与组织特异性表达,但仍需实验验证。在植物的生长发育过程中,光不但作为一种重要的信号来调控相关基因的表达,而且还直接参与光合作用[29]。GhRCAα启动子区光响应元件的大量存在可能参与GhRCAα的光调控及光合组织叶片中GhRCAα的大量表达。另外,昼夜节律响应元件circadian及同时参与生物钟及光响应的调控元件I-box[30-32]均存在于GhRCAα的启动子区,说明其表达可能受到光周期的调节,这与先前报道的GhRCAα的表达具有昼夜节律性的结果相一致[15]。对棉花[15]、水稻[33]和菠菜[34]的RCA研究表明,45 kDa(RCAα)亚型可能在光合机构适应体外中度热胁迫方面起着重要作用,热激响应元件HSE特异存在于GhRCAα启动子区可能赋予该基因在热胁迫条件维持下Rubisco活性方面的重要作用。总的来说,与其他物种一样[5-8],棉花的GhRCAα表达具有组织特异性,且可能受热胁迫和昼夜模式的影响,该基因启动子区相关调控元件的存在可能决定了该基因的表达特性。然而,GhRCAα启动子区哪些核心元件参与调控GhRCAα的表达仍不清楚。大量逆境响应元件及植物激素响应元件存在GhRCAα启动子区是否意味着该基因在植物应对逆境胁迫方面也具有重要作用,在今后的研究中,通过启动子区的缺失试验分析、定点突变及逆境条件下基因表达特性研究,将有助于了解GhRCAα启动子调控目标基因表达的分子机制。
本研究克隆获得的GhRCAα启动子可以驱动GUS基因的表达,表明该启动子片段具有驱动目标基因表达的活性,因此,有望用于植物的遗传转化,进而更好地调控重要基因的特异性表达。本研究结果不仅有助于进一步深入认识棉花 GhRCAα基因功能及其表达调控规律,也可为植物遗传转化提供一种组织特异型或诱导型的启动子。
[1] Parry M A, Reynolds M, Salvucci M E, et al. Raising yield potential of wheat. Ⅱ. Increasing photosynthetic capacity and efficiency [J]. Journal of Experimental Botany, 2011, 62(2):453-467.
[2] Portis A R. Rubisco activase-Rubisco′s catalytic chaperone [J]. Photosynthesis Research, 2003, 75(1):11-27.
[3] Chao M, Yin Z, Hao D, et al. Variation in rubisco activase (RCAβ) gene promoters and expression in soybean(Glycine max (L.) Merr.)[J]. Journal of Experimental Botany, 2014, 65(1):47-59.
[4] Yin Z, Zhang Z, Deng D, et al. Characterization of Rubisco activase genes in maize:an α-isoform gene functions alongside a β-isoform gene [J]. Plant Physiology, 2014, 164(4):2096-106.
[5] Jiang Y, Wang J, Tao X, et al. Characterization and expression of Rubisco activase genes in Ipomoea batatas [J]. Molecular Biology Reports, 2013, 40(11):6309-6321.
[6] Shan X, Wang J, Chua L, et al. The role of Arabidopsis Rubisco activase in jasmonate-induced leaf senescence [J]. Plant Physiology, 2011, 155(2): 751-764.
[7] Xu K, He B, Zhou S, et al. Cloning and characterization of the Rubisco activase gene from Ipomoea batatas(L.)Lam [J]. Molecular Biology Reports, 2010, 37(2): 661-668.
[8] Wang D, Xie S Z, Yang J, et al. Molecular characteristics and expression patterns of Rubisco activase, novel alternative splicing variants in a heterophyllous aquatic plant, Sagittaria graminea [J]. Photosynthetica, 2014, 52(1): 83-95.
[9] Orozco B M, Ogren W L. Localization of light-inducible and tissue-specific regions of the spinach ribulose bisphosphate carboxylase/oxygenase (rubisco) activase promoter in transgenic tobacco plants [J]. Plant Molecular Biology, 1993, 23(6):1129-1138.
[10] Liu Z, Taub C C, Mcclung C R. Identification of an Arabidopsis thaliana ribulose-1, 5-bisphosphate carboxylase/oxygenase activase (RCA) minimal promoter regulated by light and the circadian clock [J]. Plant Physiology,1996, 112(1):43-51.
[11] Qu D, Song Y, Li W, et al. Isolation and characterization of the organ-specific and light-inducible promoter of the gene encoding rubisco activase in potato(Solanum tuberosum) [J]. Genetics and Molecular Research,2011, 10(2):621-631.
[12] Yang Z, Lu Q, Wen X, et al. Functional analysis of the rice rubisco activase promoter in transgenic Arabidopsis [J]. Biochemical and Biophysical Research Communications,2012, 418(3):565-570.
[13] Connors B J, Miller M, Maynard C A, et al. Cloning and characterization of promoters from American chestnut capable of directing reporter gene expression in transgenic Arabidopsis plants [J]. Plant Science,2002, 163(4):771-781.
[14] Salvucci M E, Van de Loo F J, Stecher D. Two isoforms of rubisco activase in cotton, the products of separate genes not alternative splicing [J]. Planta,2003, 216(5):736-744.
[15] DeRidder B P, Salvucci M E. Modulation of rubisco activase gene expression during heat stress in cotton (Gossypium hirsutum L.) involves post-transcriptional mechanisms [J]. Plant Science,2007, 172(2):246-254.
[16] Lescot M, D hais P, Thijs G, et al. PlantCARE, a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J]. Nucleic Acids Research,2002,30(1):325-327.
[17] Jefferson R A, Kavanagh T A, Bevan M W. GUS fusions:beta-glucuronidase as a sensitive and versatile gene fusion marker in higher plants[J]. The EMBO journal,1987, 6:3901-3907.
[18] Zhang T, Hu Y, Jiang W, et al. Sequencing of allotetraploid cotton (Gossypium hirsutum L. acc. TM-1) provides a resource for fiber improvement [J]. Nature Biotechnology, 2015, 33(5):531-537.
[19] 范 繁, 刘建国, 白国辉, 等. 转基因工程植物启动子的研究进展[J]. 贵州农业科学, 2015,43(4):25-30.
[20] 成善汉,谢从华,柳 俊, 等.马铃薯低温启动子CIP的克隆及其功能鉴定[J]. 贵州科学, 2008, 26(1):19-23.
[21] 赵红玉, 徐 磊, 魏溪涓, 等. 一个新水稻根尖特异表达启动子的分离与鉴定[J]. 中国水稻科学, 2014, 28(4): 351-357.
[22] 文添龙, 刘雪梅, 冀亚萍, 等. 高等植物胁迫诱导型启动子的研究进展[J]. 西北植物学报, 2014, 34(1): 206-214.
[23] 贺红霞, 陈 亮, 林春晶, 等. 组织特异性启动子在作物基因工程中的研究进展[J]. 中国农学通报, 2014, 30(9): 225-231.
[24] Law D R, Crafts-Brandner S J, Salvucci M E. Heat stress induces the synthesis of a new form of ribulose-1, 5-bisphosphate carboxylase/oxygenase activase in cotton leaves [J]. Planta, 2001, 214(1):117-125.
[25] Rushton P J, Reinst dler A, Lipka V, et al. Synthetic plant promoters containing defined regulatory elements provide novel insights into pathogen-and wound-induced signaling [J]. Plant Cell, 2002, 14(4):749-762.
[26] Gurr S J, Rushton P J. Engineering plants with increased disease resistance:what are we going to express[J]. Trends in Biotechnology, 2005, 23(6):275-282.
[27] Lam E, Chua N H. ASF-2:a factor that binds to the cauliflower mosaic virus 35S promoter and a conserved GATA motif in Cab promoters [J]. Plant Cell, 1989, 1(12):1147-1156.
[28] Gotor C, Romero L C, Inouye K, et al. Analysis of three tissue-specific elements from the wheat Cab-1 enhancer [J]. Plant Journal, 1993, 3(4):509-518.
[29] Lau O S, Xing W D. Plant hormone signaling lightens up:integrators of light and hormones [J]. Current Opinion in Plant Biology, 2010, 13(13):571-577.
[30] Borello U, Ceccarelli E, Giuliano G. Constitutive, light-responsive and circadian clock-responsive factors compete for the different I box elements in plant light-regulated promoters [J]. Plant Journal,1993,4(4):611-619.
[31] Terzaghi W B, Cashmore A R. Light-regulated transcription [J]. Annual Review of Plant Biology, 1995, 46(46):445-474.
[32] Agius F, Amaya I, Botella M A, et al. Functional analysis of homologous and heterologous promoters in strawberry fruits using transient expression [J]. Journal of Experimental Botany, 2005, 56(489):37-46.
[33] Wang D, Li X F, Zhou Z J, et al. Two rubisco activase isoforms may play different roles in photosynthetic heat acclimation in the rice plant [J]. Physiologia plantarum, 2010, 139(1):55-67.
[34] Crafts-Brandner S J, van de Loo F J, Salvucci M E. The two forms of ribulose-1, 5-bisphosphate carboxylase/oxygenase activase differ in sensitivity to elevated temperature [J]. Plant Physiology,1997,114(2):439-444.