作者简介:石嘉琦(1995—),女,河北沧州人,在读硕士,主要从事设施农业减灾机制研究。
为了揭示果期高温胁迫下氮素施用水平对黄瓜叶绿素荧光特性的影响过程与机制,以津优101号黄瓜为试验材料,以28 ℃/18 ℃为对照,设置了35 ℃/25 ℃、38 ℃/28 ℃、41 ℃/31 ℃ 3个高温处理,施氮量设置0(N0),160(N1),240(N2),320(N3)kg/hm2 4个水平,共16个处理,每个处理3次重复。果期高温胁迫9 d后测定了黄瓜功能叶片的荧光诱导动力学参数,并探讨了各处理间变化差异的原因。结果表明,果期高温胁迫后黄瓜叶片光系统Ⅱ(PSⅡ)反应中心显著受损,叶片的最大荧光(Fm)、最大光化学量子产量(Fv/Fm)、光合性能指数(PIabs)、Fm与荧光曲线围成的面积(Area)均显著降低。35 ℃胁迫下各施氮处理黄瓜叶片的ΔWO-J和ΔWO-K均为负值,放氧复合体(OEC)未失活且PSⅡ中心类囊体之间的能量传递顺畅; 而38 ℃胁迫下N2处理和41 ℃胁迫下N1处理黄瓜叶片的ΔWO-J均为正值,OEC失活,且N1~N3处理的叶片ΔWO-K均为正值,PS Ⅱ中心类囊体之间的能量传递受阻。高温胁迫下施氮可显著增加黄瓜叶片的叶绿素含量及Fm、Fv/Fm、PIabs、PItotal、Area、Sm,增强OEC活性且促进PS Ⅱ中心类囊体之间的能量传递; 高温胁迫下黄瓜叶片PS Ⅱ单位活性反应中心的吸收光能(ABS/RC)、捕获光能(TRo/RC)、热耗散光能(DIo/RC)均表现为随着施氮水平的提高呈下降趋势,而电子传递的能量(ETo/RC)则呈上升趋势。施氮量和温度对黄瓜叶片荧光特性和产量存在显著的交互效应,在果期35,38,41 ℃高温环境中,施氮量分别为236,283,177 kg/hm2时黄瓜叶片光合作用较旺盛,且能获得较高产量。因此,果期高温胁迫下合理施氮可以提高黄瓜叶片PS Ⅱ的OEC活性,促进能量传递,减缓PS Ⅰ受体侧末端电子受体库的抑制,促进叶片光合作用的有序进行。
To reveal the effect process and mechanism of nitrogen application level on the chlorophyll fluorescence characteristics of cucumber in fruit stage under high-temperature stress,the Jinyou 101 cucumber was used as the tested material,the air temperatures were set at 35 ℃/25 ℃,38 ℃/28 ℃,41 ℃/31 ℃,in the same time the 28 ℃(daily maximum temperature)/18 ℃(daily minimum temperature)was as the control(CK);the nitrogen(N)application level was set at 0(N0),160(N1),240(N2),320 kg/ha(N3);total 16 treatments and three duplicates.The dynamic parameters of chlorophyll fluorescence of cucumber functional leaves were measured systematically after 9-days high-temperature stress in fruit stage,the differences between in various treatments were also discussed.The PSⅡ reaction centre of cucumber leaves were significantly damaged and the maximum fluorescence(Fm),maximum photochemical quantum yield(Fv/Fm),photosynthetic performance index(PIabs),area enclosed by Fm and fluorescence curve(Area)were significantly decreased after high-temperature stress in fruit stage.Under the 35 ℃ high-temperature stress,the values of ΔWO-J and ΔWO-K were negative in treatment N1—N3,and the oxygen evolution complex(OEC)was not inactivated.At the same time,the energy transfer between PSⅡ central thylakoids was unhindered.However,the ΔWO-J of leaves was positive in treatment N1 under 38 ℃ and treatment N2 under 41 ℃,which means the OEC was inactivated.Therefore,the energy transfer between PSⅡ central thylakoids was blocked due to the positive ΔWO-K in treatment N1—N3 under the 38,41 ℃.Under the high-temperature stress,the nitrogen application significantly increased the chlorophyll content,Fm,Fv/Fm,PIabs,PItotal,Area and Sm of cucumber leaves,and enhanced the OEC activity and smooth the energy transfer between the PSⅡ central thylakoids;the ABS/RC,TRo/RC and DIo/RC of cucumber leaves also decreased with the increase of nitrogen application level while the electron transfer energy(ETo/RC)increased.Nitrogen application rate and temperature had significant interactive effects on the fluorescence characteristics and yield of cucumber leaves.Under the 35,38,41 ℃high-temperature stress in fruit stage,when the nitrogen application rates were 236,283,177 kg/ha respectively,the photosynthesis of cucumber leaves was stronger and higher yield could be obtained.Therefore,the reasonable nitrogen application could improve the OEC activity of PSⅡ,promote energy transfer,and slow down the inhibition of electron receptor pool on the side of PSⅠ receptor of cucumber leaves under the high-temperature stress in fruit stage,and also improve the orderly progress of photosynthesis.
夏季设施内温度频繁高于35 ℃严重影响了设施黄瓜的产量与品质[1]。有研究发现, 高温胁迫下黄瓜花器官发育不良、蕾期黄化凋萎、化果数增加而结实率下降[2]; 而42 ℃高温处理7 d后黄瓜植株则无果实[3]。如何有效缓解高温胁迫对设施黄瓜的损害一直是设施栽培中关注的焦点问题。高温胁迫下植物叶片光系统Ⅱ (PSⅡ )反应中心最为敏感, 而通过快速叶绿素荧光诱导曲线分析方法(JIP-test)可有效判断高温胁迫下PSⅡ 反应中心光合作用过程的变化, 因此, 常常被用于作物逆境生理的研究[4, 5]。徐向东等[6]研究发现, 42 ℃高温胁迫下, 黄瓜叶片PSⅡ 的初始荧光(Fo)显著增加, 而最大荧光(Fm)和最大光化学量子产率(Fv/Fm)则显著降低, 叶片PSⅡ 受体侧受伤, 电子传递能力降低。醌库容量(Sm)的大小可以反映电子受体QA完全被还原所需要能量的高低, 而高温胁迫下光叶眼子菜的Sm显著变小, 电子传递速率显著降低[7]。高温胁迫导致PS Ⅱ 供体侧受到伤害后, 在极短时间内叶绿素荧光强度就会显著上升, 且在0.3 ms出现拐点K; 而植物叶片中放氧复合体(OEC)活性的变化可以有效表征PS Ⅱ 供体侧的损伤程度[8]。有研究发现, 35 ℃高温胁迫导致番茄叶片OEC的功能受损, 使得K点的相对可变荧光值较25 ℃显著增大[9]。高温胁迫下作物叶片的吸收光能(ABS/RC)、捕获光能(TRo/RC)、电子传递的能量(ETo/RC)等光合机构的能量与单位反应中心的比值(比活性)也会明显下降[10]。
氮是参与叶片叶绿素合成与分解、光合作用、核酮糖-1, 5-二磷酸羧化酶(Ru BPCase)活性等光合作用各个环节的重要营养元素; 氮素供应直接或间接地影响着作物的光合作用, 调控着光合电子传递链蛋白、天线色素蛋白复合体和光合酶的组成[11]; 而作物对氮素的吸收和利用影响着叶片对光能的吸收、转换、类囊体膜上的电子传递及光合磷酸化的能力[12, 13]。有研究发现, 高温胁迫下, 氮素添加可以促进水稻叶片叶绿素含量的增加, 增强叶肉细胞光合活性及叶片吸光强度, 保证光合作用的有序进行[14]; 而合理的氮素供应可以通过能量调节使叶片最大限度利用吸收的光能, 在一定程度上减轻高温导致的过多激发能对光合器官的破坏, 从而使PSⅡ 的Fv/Fm保持在较高的水平上, 提高了作物叶片对高温逆境的适应性[15, 16, 17]。可见, 氮素的合理施用是高温胁迫下有效减缓作物叶片光合机构功能受损的潜在有效措施之一, 而关于氮素调控减缓设施黄瓜高温迫害的荧光机制研究鲜有报道。
因此, 本研究基于盆栽试验, 分析了高温胁迫与不同氮素供应水平下津优101号黄瓜叶片叶绿素含量、荧光产量、光化学活性、PSⅡ 反应中心活性、性能指数及荧光差异动力学曲线的变化差异与机制, 研究结果可以为设施黄瓜高温灾害防御及氮素优化管理提供科学依据及实践指导。
试验于2020— 2021年在南京信息工程大学农业气象试验站(E118° 71', N32° 21')Venlo型试验玻璃温室和智能人工气候箱(TPG1260, 澳大利亚)中进行。在试验站内选择地势平坦田块, 按“ S” 形采集表层土壤(0~10 cm)15~20点, 混合均匀后, 取约1 500 kg土壤样品、风干, 挑拣出大的根系与石砾后, 磨细过5 mm筛备用。供试品种为黄瓜津优101号(Jinyou 101), 采用盆栽种植, 盆上口直径为24.0 cm, 盆底直径为19.5 cm, 高为26.5 cm, 每盆装过5 mm筛的风干土8.0 kg。每盆播种3粒, 待黄瓜长出四叶一心时, 保留一棵壮苗, 而后开始进行施氮处理, 试验设0(N0), 160(N1), 240(N2), 320(N3) kg/hm2等4个氮素水平, 每个水平重复3次, 整个生育期P2O5与K2O的用量分别为90, 180 kg/hm2。所施氮肥为尿素(N≥ 46.4%), 磷肥为过磷酸钙(P2O5≥ 12%), 钾肥为氯化钾(K2O≥ 60%), 所有肥料分别在幼苗期(20%)、花期(20%)、果期(60%)水溶解后施入盆中。
待黄瓜第1棵根瓜坐住后, 将盆栽放入智能人工气候箱中进行高温处理, 以28 ℃(日最高气温)/18 ℃(日最低气温)为对照, 设计35 ℃/25 ℃、38 ℃/28 ℃、41 ℃/31 ℃共3个高温水平, 日最高气温和逐时气温参考南京地区高温季节日变化设置[18], 每小时的温度通过程序控制。光合有效辐射6:00— 18:00设定(PAR)为1 000 μ mol/(m2· s), 其他时间段为0 μ mol/(m2· s), 空气湿度均设定为50%~55%, 高温处理9 d后用植物效率分析仪测定黄瓜叶片荧光参数并绘制叶绿素荧光诱导曲线(OJIP), 高温处理结束10 d后统计黄瓜产量。
1.2.1 土壤理化性质和叶绿素含量的测定 土壤理化性质参考鲁如坤[19]方法测定, 营养土pH值采用1.0 mol/L KCl溶液浸泡, 电位法测定, 液土比为2.5:1.0; 有机质采用高温外热重铬酸钾氧化-容量法测定; 土壤总氮采用H2SO4-H2O2消解后, 用全自动凯氏定氮仪(K9860)测定消解液中氮含量; 叶绿素含量采用紫外分光光度计法测定[20]。
1.2.2 荧光参数测定及快速叶绿素荧光诱导(OJIP)曲线的绘制 叶绿素荧光采用植物效率分析仪(Pocket PEA, 英国)测定, 每个处理重复测定3株, 测定项目包括初始荧光(Fo)、最大荧光(Fm)、最大光化学量子产量(Fv/Fm), 光合性能指数(PIabs)、综合性能指数(PItotal)、Fm与荧光曲线围成的面积(Area)、醌库容量(Sm)、单位活性反应中心吸收的光能(ABS/RC)、热耗散的能量(DIo/RC)、捕获的用于还原QA的光能(TRo/RC)和用于电子传递的能量(ETo/RC), 并将荧光强度值与响应时间对数值进行拟合后, 以时间对数值为横坐标绘制OJIP曲线[21]。为了进一步比较不同施氮处理下黄瓜叶片叶绿素荧光诱导曲线的特异性, 将不同时间段内的曲线标准化为相对可变荧光(一般用W表示), 即将O点的相对荧光强度定义为0, 分别将K、J、I和P点的相对荧光强度定义为1进行标准化, 并计算O-K和O-J的相对可变荧光的差值(Δ W)[22]。
数据统计分析采用Microsoft Excel 2016和SPSS 20.0软件, 绘图采用Origin 2017和GraphPad Prism 8.0软件。
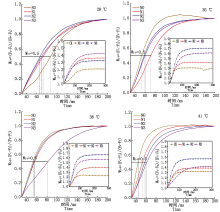
与对照温度相比, 果期高温胁迫下N3处理黄瓜叶片Chla和Chla+Chlb分别显著增加了25.2%~39.4%和40.5%~51.9%(P< 0.05); 35 ℃胁迫下N1处理黄瓜叶片Chla、Chlb和Chla+Chlb分别显著增加43.5%, 67.0%, 49.9%(P< 0.05), 38, 41 ℃胁迫则无显著变化; 果期高温胁迫下N2处理黄瓜叶片Chla、Chlb和Chla+Chlb均无显著变化。与N0处理相比, 施氮可以使果期高温胁迫下黄瓜叶片Chla、Chlb和Chla+Chlb显著增加1.1~4.3倍(P< 0.05)(图1)。
2.2.1 初始荧光(Fo)和最大荧光(Fm) 与对照温度相比, 果期高温胁迫下施氮处理的黄瓜叶片Fm显著降低了6.4%~30.7%(P< 0.05); 38 ℃胁迫下N0、N1处理的黄瓜叶片Fo分别显著降低了18.7%, 18.5%(P< 0.05), 41 ℃胁迫下N1处理的黄瓜叶片Fo显著降低了9.8%(P< 0.05), 其他处理则无显著变化(图2)。与N0处理相比, N2、N3处理使35 ℃胁迫下黄瓜叶片的Fm和Fo分别显著提高了49.6%, 52.5%, 14.6%, 17.6%(P< 0.05), 但N2、N3处理间差异不显著; N3处理使38 ℃胁迫下黄瓜叶片的Fm显著提高了28.8%(P< 0.05), N2处理则使Fo显著提高了18.4%(P< 0.05), 其他处理无显著变化; N2、N3处理使41 ℃胁迫下黄瓜叶片的Fm显著提高了16.0%, 14.9%, Fo无显著变化(图2)。
 | 图2 果期高温胁迫下施氮水平对黄瓜叶片Fo、Fm的影响Fig.2 Effect of nitrogen added on the Fo and Fm of cucumber leaves under high temperature stress in fruit stage |
2.2.2 光化学量子产率(Fv/Fm)和性能指数 与对照温度相比, 果期高温胁迫下N2处理黄瓜叶片的Fv/Fm显著降低了5.1%~6.7%(P< 0.05); 35, 41 ℃胁迫下N1处理黄瓜叶片的Fv/Fm分别显著降低了10.3%, 3.9%(P< 0.05); 35 ℃胁迫下N3处理黄瓜叶片的Fv/Fm显著降低了6.2%(P< 0.05), 其他处理无显著变化(图3-A)。与N0处理相比, N2、N3处理使35 ℃胁迫下黄瓜叶片Fv/Fm显著提高了10.2%~10.4%(P< 0.05); N3处理使38 ℃胁迫下黄瓜叶片Fv/Fm显著提高了3.2%(P< 0.05); N2与N3处理使41 ℃胁迫下黄瓜叶片Fv/Fm分别显著提高了3.9%, 5.1%, 其他处理无显著变化(图3-A)。
 | 图3 果期高温胁迫下施氮水平对黄瓜叶片PSⅡ 光化学活性的影响Fig.3 Effect of nitrogen added on the PSⅡ photochemical activity of cucumber leaves under high temperature stress in fruit stage |
与对照温度相比, 果期35 ℃胁迫下N1~N3处理的黄瓜叶片PIabs显著降低了32.1%~70.2%(P< 0.05), 38 ℃胁迫下N2处理和41 ℃胁迫的N1处理的黄瓜叶片PIabs分别显著降低了9.3%, 51.1%(P< 0.05), 其他处理无显著变化。与N0处理相比, N2、N3处理使35, 41 ℃胁迫下黄瓜叶片的PIabs显著提高了9.3, 9.1, 3.4, 4.9倍, 使叶片的PItotal显著提高了12.0, 9.0, 4.3, 4.2倍(P< 0.05); N3处理使38 ℃胁迫下果期黄瓜叶片的PIabs和PItotal分别显著提高了0.9, 1.2倍(P< 0.05)(图3-B、C)。
2.2.3 PSⅡ 反应中心活性 与对照温度相比, 35 ℃胁迫下N1处理的黄瓜叶片ABS/RC、DIo/RC分别显著提高了16.6%, 65.0%, ETo/RC则显著降低了17.0%(P< 0.05), TRo/RC无显著变化; 38 ℃胁迫下N2处理的黄瓜叶片ABS/RC、DIo/RC分别显著提高了19.3%, 51.5%(P< 0.05), N3处理的TRo/RC、ETo/RC则分别显著降低了18.3%, 19.8%(P< 0.05); 41 ℃胁迫下N1处理的黄瓜叶片仅ETo/RC显著降低了16.8%(P< 0.05), 其他指标无显著变化。与N0处理相比, N2处理使35, 41 ℃胁迫下黄瓜叶片的ABS/RC、DIo/RC、TRo/RC分别显著降低了46.0%, 59.0%, 40.4%和18.0%, 28.0%, 14.4%(P< 0.05), ETo/RC则提高了16.7%, 40.9%; N3处理使38 ℃胁迫下黄瓜叶片的ABS/RC、DIo/RC和TRo/RC分别显著降低了24.0%, 33.4%, 20.8%(P< 0.05), ETo/RC无显著变化(表1)。
| 表1 果期高温胁迫下施氮水平对黄瓜叶片PSⅡ 反应中心活性参数的影响 Tab.1 Effect of nitrogen added on the PSⅡ photochemical activity in reaction center of cucumber leaves under high temperature stress in fruit stage |
2.2.4 PSⅡ 受体侧醌库容量 与对照温度相比, 果期高温胁迫下N1处理的黄瓜叶片Area显著降低了36.2%~43.2%(P< 0.05), 35 ℃胁迫下N3处理和38 ℃胁迫下N2处理的黄瓜叶片Area则分别显著降低了24.7%, 22.6%; 38, 41 ℃高温胁迫下N1处理的黄瓜叶片Sm分别显著降低了16.7%, 22.9%(P< 0.05), 而35, 41 ℃胁迫下N2处理的黄瓜叶片Sm则分别显著增加了25.1%, 27.7%(P< 0.05), 其他处理无显著变化。与N0处理相比, N2、N3处理使35 ℃胁迫下黄瓜叶片的Area和Sm分别显著提高了2.8, 2.7, 1.3, 1.2(P< 0.05)倍; N3处理使38 ℃胁迫下黄瓜叶片的Area和Sm显著提高了1.3, 0.7(P< 0.05)倍; N2、N3处理使41 ℃胁迫下黄瓜叶片的Area和Sm分别显著提高了1.6, 1.7倍和1.1, 1.3(P< 0.05)倍, 且N2和N3处理间差异不显著(图4)。
2.3.1叶绿素荧光动力学曲线 与对照温度相比, 果期高温胁迫下黄瓜叶片I点(30 ms)上升缓慢且P点(200 ms)的叶绿素荧光强度(FI)均有不同程度的降低; 各温度下N0处理的黄瓜叶片FJ(2 ms处荧光强度)均变大且在0.3 ms处出现拐点K, I点(30 ms)上升缓慢且P点的FI最低, 施氮后各温度处理的黄瓜叶片I点和P点的FI均得到提高, 其中35, 38 ℃胁迫下N3水平的Ⅰ 点上升较快; 41 ℃胁迫下N2水平的I点上升较快(图5)。
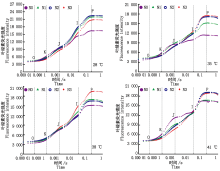 | 图5 果期高温胁迫下施氮水平对黄瓜叶片OJIP曲线的影响Fig.5 Effect of nitrogen added on the OJIP curve of cucumber leaves under high temperature stress in fruit stage |
2.3.2 放氧复合体(OEC) Δ WO-J为正值表明OEC失活, 为负值表明OEC未失活。由图6可知, 对照温度和35 ℃胁迫下, 各施氮处理的果期黄瓜叶片的Δ WO-J均为负值, OEC未失活; 38 ℃胁迫下N2处理的Δ WO-J在0.05~0.70 ms出现正值, OEC出现失活现象, N1、N3处理的OEC未失活, 且N3处理OEC活性最强; 41 ℃胁迫下N1处理的黄瓜叶片的Δ WO-J在0.05~ 0.30 ms出现正值, OEC轻微失活, N2和N3处理黄瓜叶片的OEC未失活。
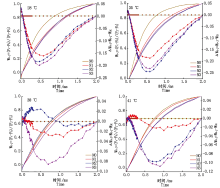 | 图6 果期高温胁迫下施氮水平对黄瓜叶片OJ相荧光差异动力学的影响Fig.6 Effect of nitrogen added on the fluorescence differential kinetics of OJ phase of cucumber leaves under high temperature stress in fruit stage |
2.3.3 类囊体间能量传递 Δ WO-K为正值说明类囊体之间的能量传递受阻, 为负值说明光合膜系统完整, 能量传递顺畅。由图7可知, 对照温度下N2处理的果期黄瓜叶片Δ WO-K始终为负值, 类囊体之间的能量传递顺畅, N1和N3处理的黄瓜叶片Δ WO-K在0.05~0.07 ms出现正值, 能量传递轻微受阻; 35 ℃胁迫下N2处理的Δ WO-K总体为负值且低于N1和N3处理, 能量传递较为顺畅; 38, 41 ℃胁迫下各施氮处理的果期黄瓜叶片的Δ WO-K整体均为正值, Δ WO-K由低到高排列依次为N3> N1> N2和N2> N1> N3, 说明果期38, 41 ℃胁迫导致PSⅡ 能量连接性受到严重阻碍, N3和N2处理分别可以有效增强类囊体之间能量的连接性。
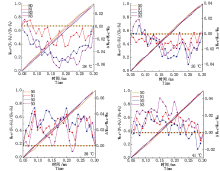 | 图7 果期高温胁迫下施氮水平对黄瓜叶片OK相荧光差异动力学的影响Fig.7 Effect of nitrogen added on the fluorescence differential kinetics of OK phase of cucumber leaves under high temperature stress in fruit stage |
2.3.4 PSⅠ 末端电子受体 WO-I≥ 1部分I~P相的振幅反映了PS Ⅰ 受体侧末端电子受体库的大小, I~P相振幅越小, 则表明PSⅠ 受体侧末端电子受体库所受抑制越强, WI-P=0.5(上升曲线达到半值)处所需时间点可用来反映PSⅠ 末端电子受体库的还原速率。由图8可知, 对照温度下施氮可以提高果期黄瓜叶片WO-I≥ 1部分I~P相的振幅, 减缓PSⅠ 受体侧末端电子受体库的抑制状况, 加快PSⅠ 末端电子受体库的还原速率, 其中N3处理的I~P相的振幅最大, 缓解作用最好, N2处理的PSⅠ 末端电子受体库的还原速率最快。果期高温胁迫下施氮可以增大黄瓜叶片WO-I≥ 1部分I~P相的振幅, 减缓PSⅠ 受体侧末端电子受体库的抑制状况, 其中N2处理效果最好; 但各施氮处理均增加了果期高温胁迫下黄瓜叶片的半衰期, 降低了PSⅠ 末端电子受体库的还原速率。
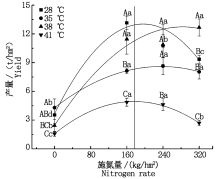
与对照温度相比, 果期35 ℃高温胁迫下N1处理的黄瓜产量降低了38.1%, 38 ℃高温胁迫下N0处理的黄瓜产量降低了31.5%, 而N3处理的黄瓜产量显著增加了35.5%(P< 0.05), 41 ℃高温胁迫下N0~N3处理的黄瓜产量显著降低了55.5%~71.2%(P< 0.05), 其他处理无显著变化。与N0处理相比, 果期35, 38, 41 ℃高温胁迫下施氮处理的黄瓜产量分别显著增加了87.3%~101.1%, 349.2%~422.5%, 71.1%~209.6%(P< 0.05)。将各温度下的产量数据与施氮量进行拟合后发现黄瓜获得最高产量时的施氮量随着温度的升高呈先上升后降低趋势, 28 ℃处理下施氮量为195 kg/hm2, 黄瓜获得最高产量12.5 t/hm2, 35 ℃胁迫下施氮量为236 kg/hm2时, 黄瓜获得最高产量8.6 t/hm2, 38 ℃胁迫下施氮量为283 kg/hm2, 黄瓜获得最高产量12.3 t/hm2, 41 ℃胁迫下当施氮量为177 kg/hm2, 黄瓜获得最高产量4.9 t/hm2(图9)。
相关分析表明, 产量与施氮量、Fm、Area、Sm、PIabs、Chla和总叶绿素含量均存在极显著正相关关系(P< 0.01), 与Fv/Fm、Chlb存在显著正相关关系(P< 0.05), 与温度(≥ 28 ℃)存在极显著负相关关系(P< 0.01), 与ABS/RC、DIo/RC、TRo/RC存在显著负相关关系(P< 0.05), 与Fo、PItotal和ETo/RC无显著相关关系(表2)。
| 表2 产量与施氮量、温度、黄瓜叶片绿素含量、各荧光指标间的相关分析 Tab.2 Correlation analysis between yield and nitrogen levels, temperature, chlorophyll content and fluorescence indexes in cucumber leaves |
方差分析结果显示, 施氮量对黄瓜产量、叶片Fm、Fv/Fm、Area、Sm、PIabs、PItotal、ABS/RC、DIo/RC、TRo/RC、Chla、Chlb和Chla+Chlb等影响均达到极显著水平(P< 0.01), 对叶片Fo的影响显著(P< 0.05), 而对叶片ETo/RC影响不显著(P> 0.05)。温度对黄瓜产量、叶片Fo、Fm、Fv/Fm、Area、PIabs、ABS/RC、DIo/RC、TRo/RC、ETo/RC、Chla和Chla+Chlb等影响达到极显著水平(P< 0.01), 对叶片PItotal、Chlb影响显著(P< 0.05), 对Sm影响不显著。施氮量和温度的交互作用对产量、Sm、PIabs、ABS/RC、TRo/RC、ETo/RC的影响均达到极显著水平(P< 0.01), 对Fm、Fv/Fm、Area、PItotal、DIo/RC影响显著(P< 0.05), 对Fo、Chla、Chlb和Chla+Chlb影响不显著(表3)。
| 表3 果期高温胁迫下不同施氮处理的黄瓜产量、叶绿素含量及荧光指标间的方差分析 Tab.3 Variance analysis of yield, chlorophyll content and fluorescence indexes of cucumber under different nitrogen treatments under high temperature stress in fruit stage |
本研究发现, 相同温度胁迫下施氮可以显著增加黄瓜叶片的Chla、Chlb和Chla+Chlb, 相同施氮水平下35 ℃轻度胁迫也可以显著增加黄瓜叶片的叶绿素含量, 这可能是因为温度影响了叶绿素合成中的酶促反应, 轻度高温和氮肥的施用在一定程度上提高了植物叶片叶绿素合成酶的活性和氮代谢相关酶活性, 从而促进叶绿素的合成, 增加叶片叶绿素含量[14]。叶绿素荧光参数是反映植物叶片光化学活性的重要指标, 可以更加具体的表现逆境下植物对光能的吸收利用与转化程度[23, 24]。本研究发现, 果期高温胁迫下合理施氮可以显著降低黄瓜叶片的ABS/RC、TRo/RC和DIo/RC, 提高ETo/RC、Fm、Fv/Fm、Plabs、Area和Sm。果期高温胁迫导致了黄瓜叶片PSⅡ 受体侧受伤, Fm显著减小, 降低了电子传递能力, 而氮的合理供应一方面可以显著提高黄瓜叶片Fm和Sm, 增大PSⅡ 受体侧电子受体库的容量, 使得传递到电子传递链的电子超过QA的电子受体的概率上升, 从而提高Fv/Fm[25, 26]; 另一方面氮的施用可以显著降低黄瓜叶片DIo/RC, 使被捕获的光能更多地用于光化学反应, 而不是用于QA的还原, 进而利于电子受体QA后的电子传递, 提高ETo/RC, 减缓PSⅡ 受体侧损伤, 促进PSⅡ 的能量转化和电子传递, 本研究结果与Kalaji等[27]、朱荣等[28]、王木兰等[29]、何海锋等[30]的研究结果相类似。在受到高温胁迫后一些黄瓜叶片的PItotal出现比室温更高的情况, 这可能与植物具有一定的抗逆性有关, 即黄瓜在受到高温胁迫后, 会激发体内的抗氧化系统, 对环境产生一定的抵抗能力[31]。
植物叶片生理的变化信息可以通过荧光参数反映到OJIP曲线上。本研究发现, 果期高温胁迫和不施氮处理的黄瓜叶片OJIP曲线中的I点上升缓慢且P点荧光强度降低, 这是因为高温胁迫和不施氮处理的黄瓜叶片PSⅡ 反应中心出现失活, 光电子从电子受体QA到QB的传递被抑制, PSⅡ 和PSⅠ 间电子分配不均、电子传递受阻导致的[32]; 施氮后各温度的黄瓜叶片I点和P点的荧光强度得到提高, 其中35, 38 ℃胁迫下N3水平的I点上升较快, 41 ℃胁迫下N2水平的I点上升较快, 这说明合理施氮可以减轻电子传递被抑制状况, 促进光系统间电子传递均衡。将OJIP曲线标准化为相对可变荧光后发现对照温度下各施氮水平的果期黄瓜叶片OEC均未失活(Δ WO-J< 0)且PSⅡ 中心类囊体能量传递顺畅(Δ WO-K< 0), 而38, 41 ℃胁迫下黄瓜叶片OEC出现失活现象(Δ WO-J> 0), 类囊体之间的能量连接性降低(Δ WO-K> 0)。这可能是由于高温胁迫下PSⅡ 供体侧流向反应中心的电子与从反应中心流向受体侧的电子失衡导致的, 电子流动不平衡会使得PSⅡ 反应中心被过剩的电子氧化, 破坏PSⅡ 供体侧结构的完整性和电子传递[33, 34]。施氮后黄瓜叶片OEC活性增强, 类囊体间的能量连接性得到提高, 其中41 ℃胁迫下N2处理的OEC整体活性较强, 类囊体间能量传递最顺畅, 38 ℃胁迫下N3处理的OEC整体活性和类囊体间能量连接性最强。可见, 氮素的合理施用有利于提高植物叶片的OEC活性, 促进PSⅡ 中心类囊体间的能量传递, 进而促进光合作用。此外, 果期高温胁迫下黄瓜叶片PSⅠ 受体侧末端电子受体库被抑制(WO-I≥ 1部分I~P相振幅越小, 抑制越强), 施氮可以增大黄瓜叶片I~P相振幅, 减缓电子受体库的抑制状况, 其中N2处理效果最好, 这可能是因为高温导致PSⅠ 产生光抑制, 而氮的合理施用可以提高黄瓜叶片光系统的抗逆性。高温胁迫加速了黄瓜叶片PSⅠ 末端电子受体库的还原速率, 且温度越高还原速度越快, 试验结果与徐超等[35]的研究结果相类似, 但高温胁迫下施氮却降低了PSⅠ 末端电子受体库的还原速率, 具体机理还有待进一步研究。
本试验结果显示, 果期高温胁迫显著降低了各施氮处理的黄瓜产量, 其中41 ℃高温胁迫产量降低幅度最大(减产55.5%~71.2%), 施氮后高温胁迫处理的黄瓜产量显著增加了71.1%~422.5%, 且将产量数据与施氮量进行拟合后发现, 黄瓜获得最高产量时的施氮量随着温度的升高呈先上升后降低趋势。高温会减弱植物PSⅡ 反应中心的原初光化学反应产生的去激发能力, 导致植物的PSⅡ 系统失活或伤害, 进而降低产量, 而不同高温条件下适宜施氮可以提高作物叶片中光合碳同化的关键酶, 有效缓解叶片的衰老, 产生更多的光合产物, 并且最大化地向果实转移, 从而增加黄瓜的产量[36]。本研究发现, 施氮量和温度对设施黄瓜叶片荧光特性和产量的影响存在交互效应, 说明温度对黄瓜叶片荧光特性和产量的影响因施氮处理的不同而有显著差异, 反之亦然。分析其原因, 可能是因为高温胁迫使黄瓜同化物向库器官的分配受到阻碍, 输出时间缩短, 输出速率下降, 产量降低, 而适量氮肥处理能够提高同化物转运能力, 促进高温胁迫下黄瓜营养器官向生殖器官的氮素转运, 从而提高氮素对黄瓜果实的贡献率[37, 38]。
果期高温胁迫显著导致了黄瓜叶片光系统反应中心受损, 而合理施氮可以有效增强PSⅡ 供体侧OEC活性和类囊体之间的能量连接性, 减轻PSⅠ 受体侧末端电子受体库的抑制状况, 缓解果期高温胁迫对黄瓜光合器官的损伤。施氮量和温度对黄瓜叶片荧光特性和产量存在显著的交互效应, 黄瓜获得最高产量时的施氮量随着温度的升高呈先上升后降低趋势, 即施氮量为236, 283, 177 kg/hm2时可分别有效提高35, 38, 41 ℃的高温胁迫下黄瓜叶片光合作用并获得最高产量。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|