作者简介:张 辉(1985—),男,河北沧县人,副研究员,博士,主要从事甜菜遗传育种与生物技术研究。
为了摸清甜菜选育进程中部分不育系和保持系材料的细胞质类型,为下一步的选育工作提供指导方向。利用分子标记引物TR1对国内总共30份甜菜试验材料开展细胞质类型的分子水平鉴定,并结合田间花期育性性状调查进行比对。结果表明,成型稳定的保持系960767和不育系N9848经过 TR1引物鉴定后的PCR电泳条带分别为750,500 bp,其胞质类型分别为N1和S型,其他试验材料检测到750 bp的材料为T152、T328、T334、T306、T360,推断其为N1型细胞质;检测到500 bp条带的材料为T766、T154、N122、I-1、B-3、Z-1、41419、10320、B-3-23、S865、S301、S151、S327、S333、S115、S305、S153、S359、S137、S163和S313,推断其为S型细胞质;检测到500~750 bp条带的材料为T302、T116。由于T302在田间调查中其对S301的不育性也具有保持能力,因此将T302和T116分为N型细胞质的另一种类型N2。同时检测到500 bp和750 bp的材料为T302、I-1和B-3的部分植株,为同时包括正常和欧文细胞质的材料,属于特质性材料。田间花粉育性调查结果T766、T154、N122、I-1、B-3、Z-1、41419、10320、B-3-23均为可育型,但鉴定其胞质类型属于S型细胞质。经分子鉴定和田间育性性状调查对比,大部分材料分子鉴定结果与育性性状调查结果一致。部分材料存在分子鉴定与育性性状结果不一致,有待于进一步调整选育方向。
In order to find out the cytoplasm types of some sterile line and maintainer line materials in the process of sugar beet breeding, it provides a guiding direction for the next breeding work. Molecular marker primer TR1 was used to identify the molecular level of 30 test materials cytoplasm types, and to compare the fertility traits in the field. The results showed that the PCR electrophoresis bands of maintainer line 960767 and sterile line N9848 were 750,500 bp.We named these cytoplasm types as N1 and S,respectively.And 750 bp bands were detected by T152,T328,T334,T306,T360,as N1 cytoplasm.The 500 bp bands detected were T766,T154,N122,I-1,B-3,Z-1,41419,10320,B-3-23,S865,S301,S151,S327,S333,S115,S305,S153,S359,S137,S163,and S313,inferred to be S type cytoplasm.The materials for the bands detected between 500 bp and 750 bp were T302,and T116.Because T302 also had the ability to maintain the sterility of S301 in field investigations,T302 and T116 were classified into another type,N2 cytoplasm type.Some plants with 500, 750 bp of materials were T302, I-1 and B-3, which included both normal and Owen cytoplasm were characteristic materials. The results of field pollen fertility survey T766, T154, N122, I-1, B-3, Z-1, 414191, 10320 and B-3-23 were all fertile, but their cytoplasm type was identified to belong to S type cytoplasm. According to molecular identification and field fertility trait survey, the results of most materials were consistent with the results of fertility trait survey. Some materials had inconsistent molecular identification and fertility trait results, requiring further adjustment of the selection direction.
甜菜是2年生常异花作物, 是重要的蔗糖榨取原料。2年生作物的生育周期较长, 制约了育种工作的进程。目前, 国内生产上使用的甜菜品种几乎都是单粒杂交种, 而单粒杂交种的制备离不开优质单粒不育系的选育工作, 需要对花期授粉杂交进行完整有效的控制。但是甜菜的花非常小, 并且属于无限花序, 不利于人工去雄工作。因此, 细胞质雄性不育(CMS)的利用为甜菜杂交种的发展提供了一种快捷高效的途径[1]。Owen[2]提出了欧文假说, 根据欧文假说的理论, 质核互作型甜菜的不育性状是由细胞质基因(S)和细胞核基因(xxzz)共同控制的。质核互作型单粒不育系的保持必须是由单粒保持系(基因型为Nxzxz, N为细胞质可育基因)与其对应的不育系(基因型为Sxzxz, S为细胞质不育基因)杂交成对保持。Matsuhira等[3]研究发现, x基因位于Ⅲ 号染色体上, 并克隆了x的1个等位基因Rf1, 其基因产物是类似于酵母线粒体蛋白质量控制的OMA1蛋白。Suketomo等[4]研究发现, 在中国水稻野生型细胞质雄性不育系中, 线粒体增强核基因逆向调控雄性不育的表达, 导致花粉败育。当恢复系的表达减少时, 育性恢复。PPR2基因编码含有五肽重复域的蛋白质, 不负责育性恢复, 而育性是通过降低逆向调控雄性不育的表达来恢复。Arakawa等[5]研究发现, 甜菜育性相关的基因rf1与育性恢复的等位基因极为相近, 但是它是一个非恢复等位基因, 对其他育性基因存在协同作用。
在甜菜育种工作中, 不育系的利用能大大提高杂交育种的效率。通常在花期进行粒性和育性调查进而对保持系和不育系材料进行有效选择。但在调查过程中难免存在漏查和误查, 从而导致后代选择的材料出现不纯的现象。Nishizawa等[6]研究发现, 在甜菜线粒体基因组有4个不相关的串联重复位点, 并发现TR1位点插在重组重复序列(rrn26)。TR1由32 bp的串联重复片段组成, 在7个基因型的甜菜中被检测出存在2~13个不同的重复数, 开发出了TR1、TR2、TR3和TR4引物。Cheng等[7]利用VNTR分子标记的方法对42个中国甜菜育种系正常和雄性不育型细胞质进行了鉴定分析, 发现在所检测的42个育种系中, 14个具有完全正常的细胞质, 11个只有欧文细胞质, 其余17个同时包括正常和欧文细胞质。Cheng等[8]利用4种线粒体微型卫星技术研究了叶用和观赏甜菜种质资源的多样性, 鉴定了11个多位点单倍型, 对不同类型的细胞质进行了梳理分类。分子鉴定技术可以在苗期进行实验室鉴定工作, 为育种工作者提供较准确的数据支撑和参考。
本研究将TR1鉴定引物应用于2年生甜菜保持系和不育系胞质类型鉴选中, 旨在为加快甜菜不育系选育、缩短育种进程提供理论指导和技术支持。
甜菜保持系材料为960767, 不育系材料为N9849, 其他待鉴定的试验材料28份, 均为内蒙古自治区农牧业科学院自育或引进材料。其中保持系960767和不育系N9849已经过多年田间调查验证并经过分子鉴定应用[9], 为已成型稳定的成对保持系和不育系材料。其他鉴定材料为经过田间性状调查待鉴定胞质类型的材料, 具体材料名称见表1。
| 表1 试验材料名称 Tab.1 Test materials names |
1.2.1 取样 在试验材料苗期取甜菜植株中心的新鲜幼嫩叶片2~3片, 称0.8~1.2 g。
1.2.2 叶片的粉碎 将取样后的新鲜嫩叶置于超低温冷冻干燥机冻干48 h, 干燥后的样品分装置于2 mL的离心管中, 然后装入钢珠, 用高通量破碎机将叶片打碎成粉末状, 之后即可用于DNA的提取。冻干后的叶片可以在干燥的环境下长期保存。
1.2.3 DNA的提取 选用新型植物基因组DNA提取试剂盒(天根), 对已经进行破碎处理的叶片进行DNA提取, 操作按照试剂盒说明书进行。
1.2.4 DNA的检测 将提取后的DNA样品5 μ L与6× Loading Buffer缓冲液1 μ L预混后点样5 μ L, 使用1%的琼脂糖凝胶在1× TAE的电泳缓冲液中进行电泳, 电泳条件为120 V, 30 min 左右。用凝胶成像系统紫外光检测电泳结果。
1.2.5 PCR扩增 引物:可变数量的串联重复TR1引物, 序列为:5'-AGAACTTCGATAGGCGAGAGG-3', 5'-GCAATTTTCAGGGCATGAACC-3'[10]。PCR反应体系为15 μ L:包括 7.5 μ L 2× Taq Master Mix, 1 μ L上游引物(0.5 μ mol/L), 1 μ L下游引物(0.5 μ mol/L), 3 μ L DNA(0.3 ng/μ L), 2.5 μ L ddH2O。PCR 反应程序:94 ℃预变性5 min; 94 ℃变性 30 s, 55 ℃ 退火30 s, 72 ℃延伸1 min, 循环35 次; 72 ℃延伸 10 min, 4 ℃保存。
1.2.6 PCR 扩增产物的检测 将PCR扩增后的产物点样5 μ L, 使用 1%琼脂糖凝胶1× TAE的电泳缓冲液进行电泳, 在 120 V 电压下电泳 30 min 左右, 凝胶成像仪照相保存图片。
1.2.7 田间育性性状调查 在甜菜开花始期(种株开花达到 15%)进行田间性状调查, 调查内容为甜菜花药的发育状况、花粉粒的特征和散粉的能力。2年生甜菜育性类型分为 5 类:全不育型、半不育一型、半不育二型、半可育型、可育型[11]。具体性状类型见参考文献[12]。
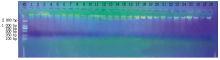
选用新型植物基因组DNA提取试剂盒(天根)对样品进行全基因组DNA的提取, 1%的琼脂糖凝胶进行检测, 点样孔上样量为5 μ L, 经检测提取的DNA浓度可以用来进行PCR检测, DNA检测结果见图1 。
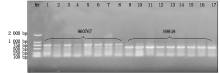
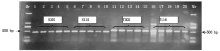
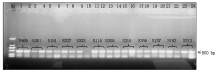
试验总共检测了30个试验材料的787个植株样品, 共检测出598份结果。在这598份材料中共检测出750 bp条带的细胞质类型116份, 材料分别为960767、T152、T328、T334、T306、T360; 检测出500 bp条带的细胞质类型300份, 材料分别为N9849、T766、T154、N122、I-1、B-3、Z-1、41419、10320、B-3-23、S865、S301、S151、S327、S333、S115、S305、S153、S359、S137、S163和S313; 检测出大于500 bp小于750 bp条带的细胞质类型84份, 材料分别为T302、T116; 同时含有500, 750 bp的细胞质类型9份, 材料分别为T302、I-1和B-3的不同植株。970767和N9849为多年田间选育鉴定的试验材料, 田间性状表现为可育型和全不育型, 为成对稳定的保持系和不育系, 经TR1引物分子标记鉴定检测后, 960767和N9849检测到的条带分别为750, 500 bp, 即750 bp条带为N1型细胞质, 500 bp条带为S型细胞质(图2)。图3显示了部分材料经TR1引物PCR扩增后的检测结果, 检测材料分别为T334、S333、S115、T116、T302、S301、960767、I-1、B-3、Z-1、41419、10320、B-3-23。这些材料中只有960767和T334为N1型细胞质, 而T302和T116为特异性类型, 其经过PCR检测后条带位置为500~750 bp(图3)。将T302、T116、S301和S115再次取样经TR1引物检测(图4), 验证后确定T302和T116检测后的条带位置为500~750 bp。结合连续几年的田间调查情况可知, T302和S301分别为可育型和全不育型材料, 并且T302对S301具有不育性状的保持能力, 因此, T302、T116类型属于另外一种N2型细胞质, 其微卫星串联重复序列重复数为9, 而N1类型细胞质微卫星串联重复序列为18。同时含有500, 750 bp条带的T302、I-1和B-3部分植株为同时包括正常和欧文细胞质的材料, 属于特质性材料[5, 7]。图5, 6分别为部分田间调查性状为可育和不育型材料经TR1引物PCR扩增后的检测结果。图5中T766存在一植株检测条带与其他不一致, 为N1胞质类型, 可能由于选择过程中不同株系材料本身存在差异或存在杂株现象。将所有检测材料按照条带位置的不同进行胞质类型分类, 具体结果见表2。
| 表2 不同试验材料经TR1引物扩增鉴定及田间育性调查 Tab.2 Identification of amplification and field breeding investigation by TR1 primers of different test materials |
根据花粉育性调查标准进行田间育性性状调查可知, 30份试验材料共计调查了787个植株样品, 其中可根据调查结果将试验材料分为以下几类:可育型包括960767、T766、T302、T152、T328、T334、T116、T360、N122、I-1、B-3、Z-1、41419、10320、B-3-23, 这些材料均存在大量花粉并进行开裂; 半可育型, 包括T306、T154, 这些材料含有无受精能力的花粉粒及少量正常的花粉粒; 全不育型, 包括N9849、S301、S151、S327、S333、S359、S313, 这些材料无花粉, 或含少数小孢子退化的花粉粒, 花粉不开裂; 半不育一型, 包括S305, 其具有退化的小孢子或较之略发达的花粉粒, 但不开裂; 半不育二型, 包括S865、S115、S153、S137、S163, 这些材料有花粉膜, 可见花粉孔, 含多个花粉粒, 但无受精能力, 花药几乎不开裂。田间调查结果对应分子鉴定结果T766、T154、N122、I-1、B-3、Z-1、41419、10320、B-3-23均为可育型, 但鉴定其胞质类型属于S型细胞质, 根据欧文理论, 这些材料的细胞核基因应该含有可育基因x, 因此, 这些材料在具体应用时不建议选作保持系材料。而S865、S115、S305、S153、S137、S163属于S型细胞质, 但花粉颜色呈淡黄和橙色, 在选育过程中建议再进行隔离套袋纯化, 待选择较纯后再用于不育系的选择。
甜菜在选育过程中育性恢复基因是一个非常复杂的性状, 这个复杂性可能是由于遗传基因的主效和微效因子Rfs, 在这个过程中还有环境因素的影响。Tourmente等[13]发现, 可变数目的串联重复序列(VNTRs)在真核生物基因组中丰富且普遍存在。这些序列与多个基因座杂交, 并且本质上是高变的, 因此被证明对遗传分析具有高度的信息性。Buard等[14] 发现, 串联重复序列通常分为微卫星序列(重复单元的长度为5 bp或更短)和微型卫星序列(重复单元的长度5~100 bp)。尽管微卫星和微型卫星有相似的结构特征, 但它们似乎在几个方面不同。例如, 微卫星起源的密切联系并且与DNA复制或错配修复系统中的缺陷相关的变异是明显的[15, 16]。而同源重组过程, 包括基因转换和重复之间的不平等交换, 被认为有微卫星参与[17, 18, 19, 20, 21]。植物线粒体基因组的一个基本标志是其跨重复序列重组的倾向。所有测序的重组重复序列都没有序列基序, 这表明重组是通过同源机制而不是位点特异性机制发生的。这增加了植物线粒体基因组也可能包含类似小卫星VNTRs的可能性。
甜菜线粒体基因组的可变数目串联重复序列(VNTRs)已被证明提供了一种快速和复杂的方法来区分正常细胞质和雄性不育细胞质的不同来源[5, 10, 22]。本研究利用其开发的TR1引物对国内部分品系材料进行细胞质鉴定, 以成型的成对保持系和不育系材料作为对照, 初步摸清了被检测材料的细胞质类型。检测到30份材料中T766、T154、N122、I-1、B-3、Z-1、41419、10320、B-3-23为与选育方向不一致的材料, 均为可育型, 但属于S型细胞质, 根据欧文理论, 这些材料的细胞核基因应该含有显性可育基因x, 需要根据育种要求进行调整。T302和T116为具有不育系保持能力的另外一种细胞质类型, 被认定为N2型细胞质类型。由于N2型细胞质和S型细胞质在条带上差异较小, 在今后的选育过程中, 应该结合串联重复序列的重复数检测进行鉴别, 为今后的不育系选育提供技术指导和参考。在检测中还有部分材料检测到不同植株间存在差异, 或者兼有2种条带类型, 推测应该是在试验中存在收获混杂及样品污染等情况。虽然该项技术不能涵盖所有的甜菜类型, 但在结合田间选育后能做出较为准确的判断。众多的科研人员从事育性基因相关的机理研究[23, 24, 25], 相信未来细胞质和细胞核特异性引物的有效结合应用将更有效地推进分子辅助选择在甜菜育种中的应用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|