作者简介:景凡丽(1995—),女,甘肃酒泉人,在读硕士,主要从事生物化学与分子生物学研究。
为明确磷酸蔗糖磷酸酶基因(SPP)的表达特征和生物学功能,进一步了解SPP参与蔗糖生物合成的调控机制。以小麦抗旱品种晋麦47的cDNA为模板克隆出3个位于第5同源群上的 TaSPP同源基因,分别命名为 TaSPP-5A、 TaSPP-5B和 TaSPP-5D。并利用生物信息学对小麦 TaSPP的理化性质、基因结构、顺式作用元件、系统进化树和蛋白保守结构域等进行分析,通过qRT-PCR分析基因 TaSPP的表达模式。结果表明, TaSPP-5A、 TaSPP-5B、 TaSPP-5D都包含8个外显子和7个内含子, TaSPP-5A和 TaSPP-5D编码422个氨基酸, TaSPP-5B编码413个氨基酸。系统进化分析显示,小麦 TaSPP基因与小麦的近缘物种在进化上处于同一分支,相似度较高。qRT-PCR表达分析结果显示, TaSPP基因在根、茎秆、旗叶、叶鞘、颖花、种子中均表达,其中在旗叶和茎秆中表达量较高;ABA、PEG-6000、NaCl和IAA胁迫均能诱导 TaSPP基因的表达,表明小麦 TaSPP基因可能在逆境胁迫过程中发挥重要作用。
In order to clarify the expression characteristics and biological functions of the sucrose phosphate phosphatase gene(SPP),and further understand the regulatory mechanism of SPP involved in sucrose biosynthesis.Herein,three TaSPP homologs, TaSPP-5A, TaSPP-5B and TaSPP-5D,located on the fifth homologous group,were cloned using the cDNA of wheat variety Jinmai 47 as the template.The physical and chemical properties,gene structure,cis-acting elements,phylogenetic tree and protein conserved domains of TaSPP were analyzed by the method of bioinformatics.The expression pattern of TaSPP was analyzed by qRT-PCR.The results showed that TaSPP-5A, TaSPP-5B and TaSPP-5D contained eight exons and seven introns. TaSPP-5A and TaSPP-5D encoded 422 amino acids,while TaSPP-5B encoded 413 amino acids.Phylogenetic analysis showed that TaSPP in wheat and its related species belonged to the same evolutionary branch with highly genetic similarity.The specific expression analysis showed that TaSPP genes were expressed in roots,stems,flag leaves,leaf sheaths,flower and seeds,whereas the higher expression levels were identified in flag leaves and stems.The expressions of TaSPP gene could be induced by ABA,PEG-6000,NaCl and IAA,indicating that TaSPP genes could play an essential role in abiotic stress tolerance in wheat.
小麦(Triticum aestivum L.)是我国四大主粮作物之一, 为全球35%以上的人口提供了大约20%的总热量和蛋白。近年来由于区域性、季节性干旱日益频发, 严重影响小麦生长发育, 从而导致小麦不同程度减产[1, 2]。因此, 提高小麦自身抗旱性, 培育耐旱品种, 降低干旱对小麦产量的影响是小麦抗旱节水研究的热点问题。研究表明, 在小麦生育后期, 干旱加速旗叶衰老, 光合速率下降, 在这种情况下, 储存在茎秆和叶鞘中的可溶性碳水化合物(Water-soluble carbohydrates, WSC)成为籽粒灌浆的主要碳源, 对补偿籽粒灌浆、改善粒质量和产量形成具有重要作用[3, 4]。因此, 研究干旱调控小麦茎秆可溶性碳水化合物积累转运的生理和分子调控机制对旱地小麦分子遗传改良具有重要意义。
蔗糖作为可溶性碳水化合物的组成部分, 在平衡小麦“ 源-流-库” 关系中起着至关重要的作用。蔗糖作为光合作用的最终产物, 从叶片中转运出来, 并通过韧皮部的筛管、伴侣细胞复合物进行运输[5], 蔗糖运输到库器官后被酶降解, 为非光合器官的生长和淀粉等贮藏积累提供了必要的碳源[6]。同时, 蔗糖还可以作为渗透保护剂和低温防护剂增强植物对非生物胁迫的耐受性[7]。
蔗糖磷酸酶和蔗糖磷酸合成酶作为合成蔗糖的关键酶, 在蔗糖合成中具有重要的作用。SPS基因已经在小麦、水稻(Oryza sativa L.)、玉米(Zea mays L.)、马铃薯(Solanum tuberosum L.)和甘蔗(Saccharum officinarum L.)等作物中被克隆, 且SPS活性与蔗糖积累呈正相关。研究发现, SPS基因序列包含3个同源基因, 在时间和空间表达各不相同[8, 9]。在棉花(Gossypium spp.)和番茄(Lycopersicon esculentum L.)中发现过表达株系的SPS基因活性增加[10, 11]。Nemati等[12]对2个干旱和敏感小麦品种进行干旱处理, 发现在耐旱小麦品种中, SPS活性更高, 说明干旱促使SPS基因的表达。相比于SPS基因, SPP基因研究相对薄弱。因此, 本研究通过克隆TaSPP的cDNA序列, 对其进行生物信息学分析, 并利用实时荧光定量PCR分析TaSPP基因的组织表达模式以及对各种非生物胁迫响应的表达特性, 以期为小麦抗逆分子遗传改良提供理论基础。
供试小麦品种为晋麦47。
挑取大小均匀的种子30粒, 用2%的次氯酸钠消毒5 min, 无菌水冲洗, 置于灭菌的培养皿中加入蒸馏水, 放置于人工气候室中培养, 光周期为16 h光照/8 h黑暗。待幼苗长至两叶一心时, 选择长势一致的幼苗, 进行非生物胁迫处理, 采用200 mmol/L NaCl、20%PEG-6000、100 μ mol/L ABA和IAA处理小麦幼苗, 分别胁迫0, 3, 6, 12 h后用剪取叶片, 经液氮处理后置于-80 ℃保存备用。将未处理的小麦幼苗转移至花盆中, 采集旗叶、叶鞘、茎、根、颖花以及灌浆中期的种子, 经液氮冷却后置于-80 ℃保存, 用于总RNA的提取。
1.2.1 引物设计与合成 利用NCBI(https://www.ncbi.nlm.nih.gov/genome/)和Ensembl Plant(https://plants.ensembl.org/)检索TaSPP基因的同源序列。由于不同拷贝的CDS序列一致性为98.53%, 因此使用Primer 5.0软件设计通用引物扩增TaSPP基因的cDNA序列, 引物送至生工生物工程(上海)股份有限公司合成, 具体序列见表1。
| 表1 扩增cDNA、荧光定量的引物 Tab.1 Primers for cDNA amplification and fluorescence quantification |
1.2.2 TaSPP基因cDNA克隆及载体构建 利用Ensembl Plants数据库获得小麦TaSPP的基因序列, 在NCBI数据库设计引物TaSPP-cDNA-F/R, 使用E.Z.N.A.® Plant RNA kit试剂盒(OMEGA, 美国)提取晋麦47叶片总RNA, 反转录试剂盒ReverTra Ace qPCR RT Master Mix with gDNA Remover(TOYOB, 日本)合成单链cDNA, 并以此为模板, 引物TaSPP-F/R和高保真Easypfu酶(全金式, 北京)扩增目标基因TaSPP的cDNA。PCR反应体系:10× Easypfu Buffer 5 μ L, dNTP 5 μ L, 上下游引物(10 μ mol/L)2 μ L, Easypfu DNA polymerase 1 μ L, 补充ddH2O至50 μ L总体积。反应条件为:94 ℃预变性5 min; 94 ℃变性30 s, 57 ℃退火30 s, 72 ℃延伸2.5 min, 共35个循环。用1%的琼脂糖凝胶电泳检测扩增产物, Tiangel Purfication Kit试剂盒(天根, 北京)切胶回收目标产物, 并与pEASY-Blunt Clonging Vector(全金式, 北京)载体连接, 42 ℃水浴热激将重组体转入大肠杆菌DH5α 中, 通过蓝白斑筛选, 将阳性克隆送往兰州天启基因生物有限公司进行测序。
1.2.3 TaSPP基因的表达与差异分析 提取晋麦47不同组织和逆境胁迫处理叶片的总RNA并反转录合成cDNA, 采用KOD SYBR qPCR Mix荧光定量试剂盒进行基因表达试验, 每个样品设置3个生物学重复。反应体系为:KOD SYBR qPCR Mix 10 μ L、上下游引物(10 μ mol/L)1 μ L、ROX Reference Dye(50× )0.4 μ L、cDNA(50 μ g/μ L)2 μ L、ddH2O 6.6 μ L, 共20 μ L体系。PCR反应在QuantStudioTM Design & Analysis Software 实时荧光定量PCR仪中进行, 扩增程序:98 ℃ 10 s, 60 ℃ 10 s, 68 ℃ 30 s, 共计40个循环。以种子作为对照, 管家基因ACTIN作为内参基因, 基因表达量采用2-Δ Δ Ct法。
1.2.4 小麦TaSPP基因的生物信息学分析 在线软件PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测TaSPP基因启动子中顺式作用元件。在线预测软件NPS-SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测TaSPP的二级结构, 统计TaSPP二级结构中α -螺旋、β -折叠、无规则卷曲、延伸链等结构所占的百分比。用ExPASy-SWISS MODE(https://swissmodel.expasy.org/)预测TaSPP蛋白的三级结构。在Ensembl Plants数据库获得TaSPP的蛋白质序列并与其他物种多序列比对和一致性分析使用ClustalW进行, 将比对结果输入MEGA 6软件中的邻接法(Neighbor-Joining), Bootstrap number 设置为1 000次重复, 构建系统进化树。利用GSDS(http://gsds.gao-lab.org/)对TaSPP基因的结构进行分析。利用在线分析软件STRING(https://string-db.org/)预测TaSPP-5A的蛋白互作。在线软件pfam(http://pfam.xfam.org/)预测TaSPS和TaSPP的功能结构域。
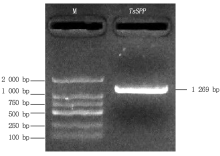
以晋麦47的cDNA为模板, 使用特异引物扩增TaSPP基因, 电泳检测出目的片段长度约为1 200 bp(图1), 与预期结果一致。测序结果发现, PCR产物包含3条cDNA序列, 位于5号染色体上, 分别命名为TaSPP-5A、TaSPP-5B和TaSPP-5D, 且3个TaSPP基因的cDNA全长分别为1 269, 1 242, 1 269 bp, 编码的蛋白分别含有422, 413, 422个氨基酸, 序列一致性高达98.42%(图2)。基因结构分析表明, TaSPP家族成员都包含8个外显子和7个内含子(图3)。
利用在线数据库PlantCARE分析TaSPP基因启动子区的序列, 结果显示, TaSPP基因存在大量的光应答元件(G-Box、Sp1)、激素应答元件和胁迫应答元件(ARE、CGTCA-motif、LTR、MBS、TGA-element、TGACG motif)。其中, 激素应答元件包括脱落酸和生长素应答元件等; 胁迫应答元件包括低温应答元件和参与干旱诱导MYB结合位点元件(图4、表2)。
| 表2 TaSPP基因的顺式作用元件及功能注释 Tab.2 Cis-acting elements and functional annotations of TaSPP gene |
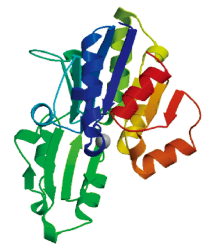
利用SOPMA对小麦TaSPP蛋白进行二级结构预测, 结果发现, TaSPP蛋白结构主要由α -螺旋、β -折叠、无规则卷曲和延伸链4种成分组成(表3), 其中α -螺旋和无规则卷曲为主要成分, β -折叠和延伸链相对较少。由于TaSPP基因的氨基酸序列高度相似, 故利用在线软件SWISS-MODEL对TaSPP-5A蛋白质的三级结构进行预测, 预测结果与二级结构相一致, 主要的结构元件是α -螺旋和无规则卷曲(图5)。
| 表3 TaSPP蛋白的二级结构预测 Tab.3 Predicted secondary structure of TaSPP protein% |
为了进一步了解TaSPP家族成员的进化关系, 将小麦3个TaSPP基因的蛋白序列与其他物种SPP蛋白序列构建系统进化树。序列分析结果显示, 小麦TaSPP-5A、TaSPP-5B和 TaSPP-5D在同一分支上, 并且与小麦近缘物种的同源性较高。TaSPP-5A和乌拉尔图小麦SPP、TaSPP-5D和粗山羊草SPP、TaSPP-5B与拟斯卑尔托山羊草SPP蛋白序列相似度较高, 进一步说明小麦TaSPP在进化过程中高度保守(图6-A)。
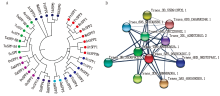
在线软件STRING进行蛋白互作预测发现, 共有11个蛋白与TaSPP-5A互作, Traes_3DL_A2EB73B1D.2、Traes_4AL_2BC235062.1和Traes_7AS_A80BE362A.1是蔗糖磷酸合成酶和蔗糖合成酶, Traes_3AS_6505083E0.1、Traes_3B_55B913FD2.1、Traes_6DS_DAA89D248.1、Traes_3B_35D6F6CE7.1、Traes_6BS_9E57D74AC.1、Traes_3DS_9B89BAD5A.1和Traes_3AS_6505083E0.1推测是与蔗糖合成酶相关的蛋白, Traes_6DS_573CAD5E0.1没有注释基因号, 因此无法对该基因进行分类(图6-B)。蛋白功能预测结果发现, 小麦含有S6PP和S6PP_C 2个结构域, 且蔗糖磷酸合成酶SPS的C肽端与SPP的N肽端具有类似的功能区域(图7)。结果暗示小表明TaSPP蛋白具有行使催化功能的完整核心元件。TaSPS与TaSPP可能以复合体形式存在。
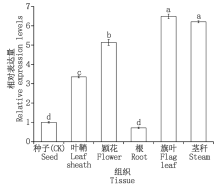
为了挖掘小麦TaSPP基因的潜在功能, 本研究基于实时荧光定量PCR, 分析TaSPP在小麦旗叶、茎秆、叶鞘、颖花、种子和根中的相对表达量。结果表明, TaSPP在小麦各组织中均有表达, 但表达量存在差异, 茎秆和旗叶中的表达显著高于其他组织, 其表达量分别是根的9.00, 8.63倍(图8)。
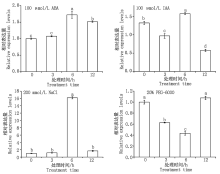
利用qRT-PCR方法分析干旱、盐、ABA和IAA处理下基因的表达情况, 可以较全面地反映TaSPP基因在非生物胁迫中的应答机制。结果表明, 在PEG-6000、NaCl、ABA和IAA胁迫下TaSPP基因的表达均发生了变化, 但由于胁迫条件的不同, 基因表达变化存在差异(图9)。其中, 在NaCl胁迫条件下, TaSPP基因上调表达, 处理6 h基因表达量最高; IAA处理下表达量呈先升后降的趋势; 在ABA处理6 h 后TaSPP基因表达量发生显著上调, 上调倍数为1.7倍; PEG-6000诱导下基因呈先降后升的趋势。
SPP作为蔗糖合成的关键酶基因, 在蔗糖合成途径发挥重要的作用。近年来, 随着生物技术的发展, 从分子角度研究磷酸蔗糖磷酸酶代谢的调控机制已成为研究热点。研究发现, 在拟南芥(Arabidopsis thaliana)、水稻、玉米、小麦、大麦(Hordeum vulgare L.)、高粱(Sorghum bicolor(L.)Moench)、辣椒(Capsicum annuum L.)和番茄等多个物种中均鉴定到SPP基因[13, 14, 15, 16, 17], 并且包含高度保守的S6PP 和 S6PP_C结构域[17, 18]。在本研究中, 小麦含有S6PP和S6PP_C共2个结构域, 表明TaSPP蛋白具有行使催化功能的完整核心元件。同时, TaSPS的C端与TaSPP的N端具有相同的催化结构域S6PP, 该结构域在维持SPP酶的催化机理和空间结构具有重要的作用。同时, Maloney等[19]研究也发现, SPS与SPP以复合物的形式存在, 共同调控植物生长和生物量的合成。
在植物中, 蔗糖作为高等植物光合作用的主要产物, 主要在叶片中合成, 并通过茎秆积累和转运, 是碳水化合运输的主要形式[20, 21]。转化酶(INV)、蔗糖合成在植物中, 蔗糖作为高等植物光合作用的主要产物, 主要在叶片中合成, 并通过茎秆积累和转运, 是碳水化合运输的主要形式[20, 21]。转化酶(INV)、蔗糖合成酶(Sus)、蔗糖磷酸合成酶(SPS)和SPP作为蔗糖代谢途径的关键酶, 对蔗糖的合成与分解具有重要的作用[5, 21, 22, 23]。黄堂伟等[21]研究表明, 木薯中SPS基因在叶片中的表达量高于茎段和块根。在水稻中, SPS基因主要在库源器官中表达[23]。在本研究中, 小麦TaSPP基因在各组织中均有一定的表达, 在旗叶和茎秆中表达量最高, 在根中表达量最低, 说明TaSPP基因在蔗糖合成以及转运过程中发挥重要作用。
转录调控在基因表达的激活和抑制中起关键作用, 基因启动子及其贡献的顺式调控元件与植物适应环境胁迫密切相关。本研究发现, TaSPP基因存在大量的光应答元件、激素应答元件和胁迫应答元件。相关研究发现, HbSPP1基因在不同叶脉中及非生物胁迫下的表达量存在差异, 推断该基因可能在蔗糖韧皮部装卸及抵御外界胁迫中具有重要的作用[24]。辣椒LZSPP1和LZSPP2基因在ABA处理后基因表达显著升高[25]。本研究发现, ABA胁迫诱导下小麦TaSPP基因上调表达, 推测TaSPP基因可能通过ABA的信号途径响应非生物胁迫。结果暗示TaSPP基因可能通过影响蔗糖的合成、积累和激素调节, 进而在小麦应对逆境胁迫过程中发挥重要作用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|