作者简介:韩晓勇(1983—),男,山西五台人,助理研究员,硕士,主要从事药食同源作物品种选育和机理研究。
为深入研究炭疽病抗病机制提供候选基因,从分子水平探索炭疽菌侵染对山药炭疽病基因转录水平的影响。苏蓣8号是高感炭疽病品系024经组培诱变所育成的高抗炭疽病山药新品种,为挖掘苏蓣8号炭疽病抗性基因,采用胶孢炭疽菌菌株4-2分别接种苏蓣8号和品系024,以未接种苏蓣8号的叶片为对照,利用转录组测序技术分析抗感材料在接种炭疽菌后不同时间点的差异表达基因。结果表明,抗感材料接种24,48,72,96 h共同差异表达基因个数分别为197,132,187,313个,去除各接种时间点共同差异表达的基因数,共获得711个差异表达基因。GO功能富集显示,差异基因主要与响应生物刺激、防卫反应、细胞壁代谢和氧化还原过程等有关。KEGG富集分析表明,生长素、茉莉酸和乙烯等防御相关的植物激素信号转导途径多个基因表达出现差异,其中5个生长素早期响应基因、茉莉酸和脱落酸合成关键酶基因均上调表达,乙烯响应因子ERF036下调表达,可能负向调控山药炭疽菌的侵染;参与次生代谢产物修饰的多个细胞色素P450基因、泛素连接酶及植物甾醇合成酶、防御素和凝集素基因上调表达;WRKY类、MYB类和TIFY类转录因子正向或负向调控抗病基因的表达,受转录调控的PR蛋白、NBS-LRR抗病基因、受体激酶等大量表达,抗氧化保护酶系统CAT和SOD成员在活性氧信号刺激下表达。此外,与淀粉和蔗糖合成有关酶上调表达,与淀粉分解有关酶下调表达。 LAX4、 IAA4、 IAA21基因表达趋势与转录组测序结果基本一致,且在抗病品种表达量显著高于感病品种,推测生长素信号途径有利于山药对炭疽病的免疫反应。
In this study,the transcription level of resistance genes to the infection of Colletotrichum gloeosporioides were explored at the molecular level and provided candidate genes for further study of disease resistance mechanism.Suyu 8 is a new yam variety highly resistant to anthracnose,which was bred by tissue culture mutagenesis of the highly susceptible strain 024.In order to find out the anthracnose resistance genes,Suyu 8 and strain 024 leaves were inoculated for different time by Colletotrichum gloeosporioides strain 4-2,the differentially expressed genes were analyzed by transcriptome sequencing.Concurrently,the uninoculation leaves of Suyu 8 were used as control.The number of differentially expressed genes,inoculation for 24,48,72,96 h,were 197,132,187 and 313,respectively.After removing the common differentially expressed genes at each time point,we obtained 711 differentially expressed genes.Go enrichment showed that the differential genes were mainly related to response to biological stimulation,defense response,cell wall metabolism and oxidation-reduction process.KEGG enrichment analysis revealed that many metabolic pathways related to plant disease resistance were changed.The expression of multiple genes varied which defense-related plant hormone signal transduction pathways,such as auxin,jasmonic acid,and ethylene.Among them,five early auxin-responsive genes,the key genes of jasmonic acid and abscisic acid biosynthesis were up-regulated,while ERF036 was down-regulated,which might negatively regulate the infection of Colletotrichum gloeosporioides.Several cytochrome P450 genes,ubiquitin ligases involved secondary metabolite modification and phytosterol synthetases,defensins and lectins were up-regulated.WRKY,MYB and TIFY transcription factors positively or negatively regulate the expression of disease resistance genes.Under the regulation of transcription factors,PR protein,NBS-LRR disease resistance genes,receptor kinases were highly expressed,the expressions of CAT and SOD genes of antioxidant protective enzyme systems were activated by reactive oxygen species.In addition,the enzymes related to starch and sucrose synthesis were up-regulated,and enzymes related to starch degradation were down regulated.The expression trends of LAX4, IAA4, IAA21 were consistent with that of transcriptome sequencing.The relative expression of LAX4, IAA4 and IAA21 in resistant varieties were significantly higher than susceptible varieties,suggesting that auxin signaling pathway is beneficial to the immune response to anthracnose for yam.
炭疽病是为害山药最为严重的病害之一, 如果未及时有效控制, 其损失可达80%以上, 甚至绝收, 严重制约着山药产业发展。山药炭疽病主要为害山药叶片, 也可为害茎蔓, 其病症状复杂, 一般先从植株下部开始发病。化学药剂是防治山药炭疽病的主要手段, 但易带来环境污染、生态失衡及食品安全等问题, 而且频繁使用农药可能会导致致病菌株变异, 出现致病性更强的毒株[1]。培育抗炭疽病的山药品种是控制田间山药病害最有效和理想的方法, 但山药以营养繁殖为主, 存在生理限制。尽管通过常规育种在培育抗炭疽病杂交种方面取得了一些进展[2], 但进展仍然缓慢。传统技术和分子技术的结合将是开发具有稳定抗性山药品种的更好方法, 以保护山药免受广谱真菌病原体的侵害, 从而改善山药品质。近年来, 基因组学辅助育种(GAB, Genome-assisted breeding)已成为一种强有力的植物育种策略, 它将基因组学与高通量表型分析相结合, 以改良作物[3]。
炭疽病抗性基因的挖掘及分子标记辅助选择, 是培育山药广谱、高效和稳定的抗病品种的重要途径。通过对易感基因型(TDa95/0310)和2种炭疽病抗性山药基因型(TDa87/01091和TDa95/0328)的比较转录组学分析, TDa95/0328和TDa87/01091分别有115, 180个高表达的EST, 它们与碳水化合物代谢、细胞壁生物合成、脂质和氨基酸代谢、次生和激素代谢、转录因子、蛋白质合成以及多种病程相关信号蛋白和宿主防御相关基因有关[4, 5]。Upadhyaya等[6]利用14 739个SNP标记定位到了8个与高粱抗炭疽病有关的位点。Yang等[7]通过图位克隆的方法从苜蓿中克隆获得RCT1基因, 该基因属于TIR-NBS-LRR类基因, 将RCT1 转化到对炭疽病敏感的苜蓿植株中后, 转基因植株表现出对炭疽病的广谱抗性。采用同源克隆和RT-PCR方法, 从草莓久香克隆到FaNBS20全长cDNA序列, 草莓抗炭疽病品种甜查理接种草莓炭疽病菌后, FaNBS20的表达水平显著提高, 而在感病品种久香FaNBS20的表达则一直处于较低水平, 表明该基因可能与炭疽病的抗性相关[8]。编码ABA-响应蛋白、亮氨酸富集蛋白、黄酮-3-羟化酶及谷胱甘肽-S-转移酶的基因在抗炭疽病高粱植株内被明显诱导表达但在易感植株内几乎检测不到, 表明这些基因在植株抗炭疽病方面可能发挥着非常重要的作用[9]。目前, 利用RNA-seq技术挖掘山药炭疽病抗性基因尚未见报道。
本试验利用RNA-seq技术分析不同时期高抗和高感品种的山药叶片受炭疽菌侵染后的基因表达变化, 挖掘山药参与炭疽病抗性相关基因, 对关键抗性基因进行表达分析, 构建山药响应炭疽病侵染的分子途径, 旨在为揭示山药抗炭疽病的分子机制, 培育山药广谱、高效和稳定的抗病品种奠定基础。
试验于2019— 2021年在江苏省农业科学院经济作物研究所实验室完成。
1.1.1 试验材料 胶孢炭疽菌菌株4-2由笔者保存于本实验室。山药品种苏蓣8号, 是江苏省农业科学院利用浙江省台州市地方紫山药品种台州紫山药经系统选育的高感炭疽病品系024, 组培诱变所形成的品种, 其薯形好, 产量高, 高抗炭疽病。用于差异基因表达分析的高感品系024和江西短紫山药、高抗品种苏蓣8号和苏蓣6号、中抗品种红河山药均种植于江苏省农业科学院南京市六合试验基地。当年繁殖的苏蓣8号和品系024的种薯, 次年用作接种材料。
1.1.2 试验处理 选取苏蓣8号和品系024的健康、无病、大小一致的种薯, 播种于铺满基质的花盆中, 置于恒温恒湿的培养环境中培养。待植株长至5~6叶期, 用2 mm左右接种针针刺展开叶叶片, 将PDA平板培养7 d后的菌株用无菌水配制成浓度为1× 106个/mL的孢子悬浮液, 均匀喷雾于植株叶片并遮防护罩保湿, 24 h后摘罩。为防止误差, 每片叶针刺2孔, 叶片正面和背面分别喷雾2次孢子悬浮液。收集苏蓣8号接种0, 24, 48, 72, 96 h(R0h、R24h、R48h、R72h、R96h), 品系024接种24, 48, 72, 96 h(S24h、S48h、S72h、S96h)的叶片, 液氮速冻后置于-80 ℃冰箱中保存。每个样品为3~5片叶的混合样, 每个处理3个生物学重复。
基于Illumina HiSeq 2500测序平台对构建好的cDNA文库进行测序, 测序工作由南京集思慧远生物科技有限公司完成。测序得到的原始图像数据文件, 经碱基识别(Base Calling)分析转化为原始测序序列(Raw Data或Raw Reads), 用Sanger质量值Q来评估原始数据的测序质量, 获得Clean data。经De novo组装后, 获得山药的Unigene库。
采用Bowtie 2将测序得到的Reads与Unigene库进行比对, 根据比对结果, 结合RSEM进行表达量水平估计。利用FPKM值计算各样品中每个基因的表达量。采用DESeq 2软件进行2组样品间的差异表达分析, 将|Fold Change|≥ 4且 FDR< 0.05作为筛选标准。筛选获得的差异基因进行GO功能富集分析和KEGG Pathway富集分析, 以P< 0.05为阈值。
选取3个差异表达基因, 利用Oligo 6软件设计引物, 以Actin基因为内参(表1), 用转录组测序同批次采集样品的cDNA为模板进行Q-PCR, 验证转录组测序数据的可靠性。设3次生物学重复, 按照2-Δ Δ Ct算法计算基因的相对表达量。
| 表1 Q-PCR基因及引物 Tab.1 The genes and primers used for Q-PCR |
在炭疽病发病盛期, 分别取品系024、江西短紫山药、苏蓣8号、苏蓣6号和红河山药的3~5片展开叶, 液氮速冻后置于-80 ℃冰箱中保存。每个品种3个生物学重复, 其中, 品系024和江西短紫山药的感病叶和健康叶分别进行取样保存。
去除含有接头的、重复的、质量低的片段, 9个样品获得Clean reads 在18 538 496~20 504 603条(表2)。各样品Clean data均达到5 561 548 900 bp及以上, GC含量均高于44%, N碱基含量均为0, Q30碱基百分比均在90%以上, 表明各样品测序所得Clean data的碱基组成基本平衡且大部分reads的碱基质量值大于30, 符合质量错误率低于1%的要求。转录组测序质量较好, 数据可靠。
| 表2 测序数据统计结果 Tab.2 The statistics of transcriptome sequencing data |
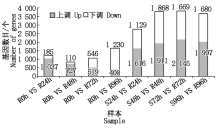
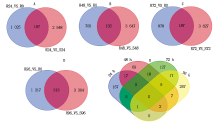
建立抗病品种接种不同时间差异基因集, 同时建立接种相同时间的抗感病品种差异基因集, 选择共同差异表达的基因, 结果表明(图1):抗感品种间与抗病品种内接种72, 96 h差异表达的基因数最多, 分别为3 814, 1 630个。差异表达基因韦恩图结果表明(图2), 接种24, 48, 72, 96 h差异表达的基因个数分别为197, 132, 187, 313个, 去除各接种时间点共同差异表达的基因数, 共获得711个差异表达的基因。
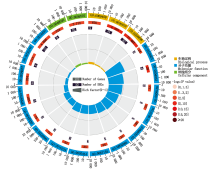
差异表达的基因GO功能分类结果表明:有666个基因被注释, 分为生物过程、细胞组分和分子功能三大类和50个亚类(图3), 其中生物过程包含20个亚类, 基因数最多的5个亚类依次是细胞过程、代谢过程、单组织过程、刺激响应和生物调节; 细胞组分包含15个亚类, 基因数最多的2个亚类是细胞和细胞部分; 分子功能包含15个亚类, 基因数最多的2个亚类是结合和催化活性。差异表达基因GO功能分类基因数占比与背景基因GO功能分类基因数占比趋势基本一致。
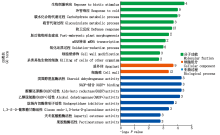
GO功能显著性富集分析表明(图4), 富集于生物过程途径的基因数最多, 为116个, 其中显著富集于响应生物刺激(GO:0050896)和应激反应(GO:00006950)terms的基因数分别为63, 44个; 其次是富集于分子功能途径的基因, 为79个; 富集于细胞组分的基因数最少, 为31个。前20条显著富集的terms中(图5), 4个差异基因富集于生物刺激响应term, 且富集程度最高; 防卫反应term富集基因数最多, 为13个; 此外, 有些基因富集于细胞壁修饰、氧化还原过程和催化酶活性, 这些基因可能均与植物抗病有关。
利用KEGG数据库对筛选出的差异基因进行了功能富集分类和Pathway注释(图6):有40个基因富集于31条信号通路, 其中23条参与代谢途径, 3条参与遗传信息处理, 分别有2条参与环境信息处理和细胞进程, 1条参与有机体系统。糖酵解/糖异生代谢途径富集的基因数最多, 为6个, 其次是植物激素信号转导途径、戊糖和葡萄糖醛酸相互转化途径, 均为5个。
对所有富集的KEGG Pathway进行筛选, 共获得10条显著富集的 Pathway(表3)。其中5条涉及糖代谢途径, 分别是戊糖和葡萄糖醛酸相互转化、糖酵解/糖异生、半乳糖代谢、淀粉与蔗糖代谢和磷酸戊糖途径; 2条涉及次生代谢产物途径, 分别是类固醇生物合成途径和托烷、哌啶、吡啶生物碱合成途径; 分别有1条涉及植物激素信号转导途径、甘油酯代谢和生物素代谢途径。
| 表3 差异表达基因显著富集的KEGG通路 Tab.3 KEGG pathways significantly enriched of differentially expressed genes |
结合KEGG富集分析对差异表达基因进一步按功能进行分类, 主要集中在糖代谢、植物与病原互作、激素代谢、次生代谢等途径。
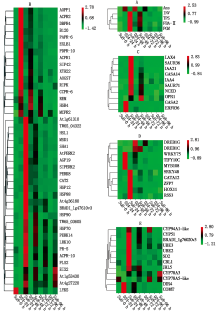
2.5.1 淀粉和蔗糖代谢相关基因表达分析 在炭疽菌侵染24 h, 与蔗糖分解有关的β -呋喃果糖苷酶(INV)和α -磷酸海藻糖合酶(TPS)、与淀粉合成有关的果糖1, 6-二磷酸醛缩酶(FBA-Ⅱ )和磷酸葡糖变位酶(PGM)均上调表达; 与淀粉分解有关的α -淀粉酶(Ams)下调表达(图7-A)。
2.5.2 植物与病原互作途径相关基因表达分析 在炭疽菌侵染24 h, 多个病程相关蛋白下调表达(图7-B), 包括PR1(AOPR1、ACPR1)、PR2(β -1-3-葡聚糖酶, ACPR2、MCPR2、SIPR2)、PR4(几丁质酶, DBPR4)、PR6(蛋白酶抑制剂, PARR-6、CCPR-6)和PDPR10(海枣核糖核酸酶), 而PR5(甜味蛋白)和ACPR-10(菠萝核糖核酸酶)上调表达; NB-ARC类抗病基因(At1g61310)和NBS-LRR类抗病基因(At4g27220、TW65_03605、TW65_04322、BRADI_1g47610v3、At4g36180、FLS2、EIX2)在炭疽菌侵染24 h均上调表达, 其中EIX2在炭疽菌侵染96 h时, 表达量最高。参与植物防卫反应的4个热击蛋白(HSP12、HSP88、HSP90、HSP70)在炭疽菌侵染24 h均上调表达, 其中HSP12和HSP88在炭疽菌侵染24 h表达量最高, 而HSP90和HSP70在炭疽菌侵染48 h表达量最高; 过氧化氢酶(CAT2)和线粒体超氧物歧化酶(MSD1)在炭疽菌侵染24 h上调表达且表达量最高; 谷胱甘肽转移酶(AOGST)在炭疽菌侵染24 h下调表达。
富含脯氨酸的伸展素类受体蛋白激酶(AtPERK2、SIPERK2、PERK8、PERK14), LRR类受体蛋白激酶(At1g53430、LRK10), 凝集素受体激酶(HSL1)在炭疽菌侵染24 h上调表达且表达量最高, 受体相互作用蛋白激酶(RIPK), 溶解素基序型激酶(LYK5), 凝集素受体激酶(B120)在炭疽菌侵染24 h下调表达; 细胞壁蛋白阿拉伯半乳聚糖蛋白(AGP19)和钙调素结合蛋白(SHA1)在炭疽菌侵染24 h上调表达, 细胞壁修饰的扩展蛋白(EXLB1)、细胞壁降解相关木葡聚糖内糖基转移酶(XTH22), 超敏相关蛋白(HSR4)和植物Remorin蛋白(REM)在炭疽菌侵染24 h下调表达。
2.5.3 激素相关基因的表达分析 在炭疽菌侵染过程中, 多个与防御相关的植物激素信号转导途径中基因表现出差异, 其中生长素信号转导起主导作用。1个生长素极性运输载体(LAX4)、4个生长素早期响应蛋白(IAA4、IAA21、SAUR36、SAUR71)在炭疽菌侵染24 h均上调表达且表达量最高; 赤霉素调节蛋白(GAGA14、GASA2)在炭疽菌侵染24 h分别上调或下调表达; 茉莉酸合成关键酶基因12-氧代植二烯酸还原酶(OPR1)和脱落酸合成关键酶基因9-顺式-环氧类胡萝卜素双加氧酶(NCED)在炭疽菌侵染24 h均上调表达, 乙烯响应因子(ERF036)在炭疽菌侵染24 h下调表达(图7-C)。
2.5.4 转录因子 转录因子在抗病信号转导途径中起重要调控作用。在炭疽菌侵染24 h, WRKY类转录因子(WRKY48)、GATA类转录因子(GATA12)、HD-ZIP类转录因子(HOX11)、bHLH-MYC(RSS3)和锌指蛋白基因(ZFP7)均上调表达, DREB类转录因子(DREB1C)在炭疽菌侵染48 h上调表达。DREB类转录因子(DREB1G)、WRKY类转录因子(WRKY75)、MYB类转录因子(MYB108)和TIFY类转录因子(TIFY10C)在炭疽菌侵染24 h下调表达(图7-D)。
2.5.5 次生代谢产物相关基因的表达分析 次生代谢产物作为生活壁垒可以直接参与植物的防御反应, 也可以作为信号物质参与植物抗病反应。细胞色素P450基因(CYP94A1-like、CYP78A3、CYP51)、泛素化连接酶(UBE2、UBE3)、防御素(SD2)、几丁质结合凝集素(CBL1)、木菠萝凝集素(JRL5)、甾醇C-24甲基转移酶(BRADI_1g76020v3)在炭疽菌侵染24 h上调表达, 其中, CYP94A1-like、CYP78A3分别在炭疽菌侵染72, 96 h表达量最高, 细胞色素P450基因(CYP78A5-like)在炭疽菌侵染72 h上调表达; 参与木质素合成的导体蛋白(DIR4)和咖啡酸3-O-甲基转移酶(COMT)受炭疽菌侵染后下调表达(图7-E)。
根据差异基因富集情况, 选择了植物激素信号转导途径中与生长素信号相关的基因, 通过Q-PCR检测其表达水平。结果表明(图8):LAX4、IAA4、IAA21在接种24 h上调表达, 与转录组测序基因表达变化趋势一致, 表明转录组测序结果是可靠的。
为进一步验证差异基因炭疽病抗性, 选择炭疽病高感品系024和江西短紫山药、高抗品种苏蓣8号和苏蓣6号、中抗品种红河山药, 进行Q-PCR分析, 其中品系024和江西短紫山药分别对感病叶和健康叶进行表达分析。结果表明(图9):IAA4、LAX4和IAA21抗病品种表达量显著高于感病品种, 其中, LAX4和IAA21在苏蓣8号的表达量显著高于苏蓣6号和红河山药; IAA4在苏蓣6号的表达量显著高于其他品种, 在苏蓣8号和红河山药表达量无显著差异。除IAA21江西短紫山药健康叶表达量显著高于感病叶外, IAA4和LAX4在感病叶和健康叶表达量无显著差异, 即健康叶不一定健康。
淀粉代谢异常是植物染病后的主要生理变化之一, 通常与淀粉合成有关的酶基因上调表达, 地上部出现淀粉积累, 地下部发生淀粉欠缺问题[10, 11]。蔗糖合酶催化蔗糖降解, 是蔗糖向淀粉转化的第一步[12]。炭疽菌侵染24 h, 苏蓣8号叶片与蔗糖分解有关的β -呋喃果糖苷酶(INV)和α -磷酸海藻糖合酶(TPS)、与淀粉合成有关的果糖1, 6-二磷酸醛缩酶(FBA-Ⅱ )和磷酸葡糖变位酶(PGM)均上调表达, 而与淀粉分解有关的α -淀粉酶下调表达(Ams), 即山药受炭疽菌侵染后, 苏蓣8号叶片较品系024出现更多的淀粉积累可能。
植物在受到病原物侵染时通过诱导产生的防卫基因表达来拮抗, 防卫基因按功能划分, 主要分为4类[13]:①病程相关蛋白基因, 编码PR蛋白; ②细胞壁修饰有关基因, 编码细胞壁中富含羟脯氨酸的糖蛋白, 过氧化物酶及硫堇等; ③清除活性氧(ROS)的防卫酶基因, 包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等; ④次生物质合成基因, 编码植保素及木质素等生物合成所需的酶。不同类别的病程相关蛋白在炭疽病侵染后表达情况不同。NB-ARC类抗病基因、NBS-LRR类抗病基因和热击蛋白在炭疽菌侵染24 h全部上调表达, 而在11个病程蛋白中, 只有PR5和ACPR10上调表达、9个受体蛋白激酶中, 6个上调表达, 3个下调表达、1个谷胱甘肽转移酶基因下调表达, 这些结果表明, 病程相关蛋白仅是山药抵抗炭疽菌侵染的部分因子, 它们与其他诸多因子共同起作用, 且在不同程度或种类的抗病品种(系)中他们的生物学功能也有差异[14]。同样, 6个细胞壁修饰蛋白中, 阿拉伯半乳聚糖蛋白(AGP19)和钙调素结合蛋白(SHA1)在炭疽菌侵染24 h上调表达, 而导致细胞壁松弛的扩展蛋白(EXLB1)和细胞壁降解相关木葡聚糖内糖基转移酶(XTH22)下调表达, 可阻止细胞壁的松弛, 增强苏蓣8号对炭疽菌的免疫功能。
正常条件下活性氧(ROS)的产生与清除处于动态平衡, 当植物在遭受逆境或胁迫时, 植物体内ROS平衡会被打破, 诱导体内积累ROS使植物发生抗病反应, 过多的ROS积累会使膜脂过氧化而使膜系统受损, 对植物产生伤害[15]。为了维持平衡, 一方面植物通过抗氧化酶系统(SOD、POD、CAT等)将活性氧分解; 另一方面依靠抗氧化次生代谢产物, 直接将ROS清除, 例如抗坏血酸、类胡萝卜素、谷胱甘肽、多酚和类黄酮等[16]。苏蓣8号受炭疽菌侵染后, 过氧化氢酶(CAT2)和线粒体超氧物歧化酶(MSD1)上调表达, MSD1可以将O2-歧化为 H2O2, CAT2通过直接将H2O2分解生成无毒害H2O和O2[17]。
CYP450s是一种广谱性生物催化酶, 参与多种代谢反应, 如脂肪酸代谢、植物激素的生物合成与降解、次生代谢产物的合成[18]。CYP94A1-like参与叶片角质的合成[19]、CYP51编码甾醇14α -去甲基化酶[20], 与甾醇C-24甲基转移酶(BRADI_1g76020v3)共同参与生物甾醇的合成[21], 叶片角质和作为质膜组分的生物甾醇合成相关基因在苏蓣8号的上调表达能有效防止病原物侵染植物组织。CYP78A家族成员(CYP78A3、CYP78A5-like)可能成为一类应用于作物改良的基因, 参与种子和器官的发育[22], 它们上调表达是否与抗病有关, 尚未见报道。防御素(SD2)、几丁质结合凝集素(CBL1)和木菠萝凝集素(JRL5)基因在苏蓣8号的上调表达, 可与真菌细胞表面的不同单糖, 多糖支链或异源多糖结合, 从而干扰真菌细胞壁的合成, 抑制其生长[23, 24]。
植物泛素化系统是在一系列酶的催化作用下, 泛素共价结合靶标蛋白对其进行泛素化修饰, 其泛素化靶标蛋白可介导抗病信号, 甚至一些病原物效应蛋白也在其宿主细胞中起泛素连接酶的作用, 并以此来干扰植物抗病反应[25]。在水稻中, E2受稻瘟病菌和植物激素诱导表达, 在激素信号传导中发挥重要的作用[26]。同样, 受稻瘟菌侵染时, 编码RING型的E3连接OsBBI1, 过表达后植株的细胞壁明显增厚, 而且感染部位的H2O2和酚类化合物大量积累, 即OsBBI1参与由细胞壁介导的水稻抗病机制[27]。苏蓣8号受炭疽菌后, 泛素化连接酶(UBE2、UBE3)上调表达, 可能有利于增强苏蓣8号的抗性。
转录因子可作为防御基因表达中的正或负调节因子, 通过其保守结构域与靶基因启动子上的特异结构特异性结合, 来实现抗逆调控功能[28]。WRKY48参与拟南芥丁香假单胞菌侵染后的防卫反应, 过表达WRKY48, 丁香假单胞菌的生长的敏感性增强与防御相关PR基因表达减少有关, WRKY48负调节PR基因的表达[29]。棉花GhWRKY48 基因对棉花枯萎病、黄萎病、水杨酸、茉莉酸均有一定的响应, GhWRKY48 基因正向调节棉花抗枯萎病反应, 负向调节棉花对黄萎病的抗性[30, 31], WRKY75正向调节茉莉酸盐介导的植物对坏死型真菌病原菌的防御[32]。本试验中WRKY48上调表达, WRKY75下调表达, 可能分别正向和负向调控山药对炭疽病的响应。表明, WRKY家族同一个基因不仅在不同的作物调控功能不尽相同, 即使在同一作物的调控功能也不同。棉花中MYB108通过与钙离子和钙调素样蛋白GhCML11协同作用正向调节棉花黄萎病响应[33]。TIFY10C是水稻中一个茉莉酸信号途径的抑制子, 通过与OsCOI1形成复合体或与其他蛋白质形成异源二聚体抑制茉莉酸信号途径, JA处理导致TIFY10C降解, 从而对白叶枯病信号作出响应[34]。苏蓣8号下调表达MYB108和TIFY10C, 可能负向调节山药对炭疽病的响应。GATA12、HOX11、RSS3、ZFP7、DREB类转录因子在植物生长发育, 激素信号途径、次生代谢产物合成、抗逆反应等方面发挥重要作用[35, 36, 37, 38, 39, 40], 在植物病害调控方面未见相关报道。
生长素信号传导过程涉及了2类转录因子, 一类是生长素响应因子AFR家族, 另一类是Aux/IAA转录因子家族, AFR能和生长素早期诱导基因如 Aux/IAA, SAUR, GH3等家族的启动子响应元件特异结合形成二聚体, 激活或者抑制基因表达。当生长素浓度较高时, 生长素与泛素连接酶复合体SCFTIR1结合后, 会促使Aux/IAA抑制因子的泛素化与降解, 产生众多ARF蛋白并激活生长素信号途径[41]。病原菌侵染导致生长素水平失衡, 进而改变其信号途径相关基因的表达。水稻GH3-2过量表达后能增强水稻对白叶枯病菌、细菌性条斑病菌和稻瘟病的抗性[42]。拟南芥生长素信号缺失突变体axr2(Auxin resistant 2) 对丁香假单胞杆菌的抗性增强, 表明生长素信号途径不利于拟南芥对丁香假单胞杆菌的免疫反应[43]。本研究中, LAX4、IAA4、IAA21、SAUR36、SAUR71在炭疽菌侵染24 h均上调表达, 且LAX4和IAA21在抗病品种表达量显著高于感病品种, 推测生长素信号途径有利于山药对炭疽病的免疫反应。
茉莉酸信号途径中茉莉酸合成关键酶基因OPR1和脱落酸合成关键酶基因NCED上调表达, 有利于增强苏蓣8号炭疽病抗性。JA在马铃薯晚疫病菌侵染期间, 会识别Pep-13致病因子, 激活茉莉酸信号途径, 诱导ROS的产生、PR基因的表达及细胞超敏死亡, 增强对马铃薯晚疫病的抗性[44]。ABA可以破坏烟草中由水杨酸介导的对烟草花叶病毒(TMV)和叶斑病的抵抗[45], 亦可控制植物气孔关闭, 促进胼胝质沉积阻止病菌侵染, 正向调控植物的抗病性[46]。油桐在尖孢镰孢菌侵染后, VmAP2/ERF036和其同源基因VfAP2/ERF036表现出相反的表达模式, VmAP2/ERF036的表达受到抑制, 表明二者的抗病调节模式不同[47]。ERF036在苏蓣8号下调表达, 可能负向调控山药炭疽菌的侵染。GASA(Gibberellic Acid-stimulated Arabidopsis)蛋白是一类CRP蛋白, 大多数成员受赤霉素调控。目前只在马铃薯、辣椒和法国菜豆中发现GASA蛋白参与植物防御反应[48, 49, 50]。但已有证据表明, GASA蛋白可通过促进水杨酸SA合成基因的表达和植物体内SA的水平来抵抗非生物胁迫[51]。本研究中GASA14在炭疽菌侵染24 h上调表达, GASA2下调表达, 它们如何参与苏蓣8号抗病性还需要进一步研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|