作者简介:魏亚蕊(1986—),女,河北石家庄人,博士,主要从事果树结实生理与分子生物学研究。
为了揭示水杨酸诱导鸭梨抗黑斑病的作用效果及机理,以河北农业大学实验农场梨园鸭梨叶片和果实为试验材料,通过组织分离法分离、纯化梨黑斑病病原菌并对其进行致病性检测,利用形态观察及真菌 ITS、 HIS、 RPB2、 ACT多基因综合鉴定法明确鸭梨黑斑病致病菌的类型;鸭梨离体叶片通过针刺接种黑斑病菌分生孢子悬浮液侵染0,6,12,24,48,72,96,120 h,通过实时荧光定量PCR检测水杨酸信号通路中相关基因的表达量变化,通过高效液相色谱(HPLC)检测0,72 h内源水杨酸含量的变化;利用不同浓度水杨酸(0,0.002,0.02,0.2,2.0,10.0,20.0 mmol/L)测定其对黑斑病菌菌丝生长的影响;采用外源0,0.02,0.2,2.0 mmol/L水杨酸处理鸭梨果实,接种黑斑病菌并观察其抗病效果。结果表明,河北农业大学实验农场梨园中鸭梨黑斑病病原菌为链格孢属链格孢菌,鸭梨离体叶片接种黑斑病菌后,72 h游离态水杨酸含量由0 mg/g增至0.02 mg/g,结合态水杨酸含量由0.47 mg/g增至1.55 mg/g,SA信号通路中相关基因 Pbrgene12425、 Pbrgene6286接种96 h与0 h相比表达量分别上调5.48,4.66倍, Pbrgene8895、 Pbrgene43605接种120 h表达量上调7.90,10.0倍,外源施加0.2 mmol/L水杨酸显著提高鸭梨果实对黑斑病的抗性。在鸭梨抗黑斑病过程中,鸭梨离体叶片游离态水杨酸含量显著增加,水杨酸信号通路中相关基因被诱导上调表达,外源施加0.2 mmol/L水杨酸可提高鸭梨果实对黑斑病的抗性。
In order to reveal the effect and molecular mechanism of salicylic acid-induced resistance to black spot disease of Yali,the leaves and fruits of Yali were used as experimental material which were collected from the experimental orchard of Hebei Agricultural University.Tissue isolation method was used to isolate and purify the pathogen of black spot disease and detected its pathogenicity.Morphological observation and multi-genes of ITS, HIS, RPB2 and ACT were used to identify the pathogen of black spot disease.The detached leaves of Yali were inoculated with conidia suspension of Alternaria alternata by acupuncture for 0,6,12,24,48,72,96 and 120 h,respectively.Real-time RT-PCR was used to analyse the expression of related genes which involved in salicylic acid signaling,and high-performance liquid chromatography (HPLC) was used to detect the content of endogenous SA at 0 and 72 h,respectively.Exogenous SA treatment with different concentrations (0,0.002,0.02,0.2,2.0,10.0,20.0 mmol/L) were used to identify the effect to the mycelial growth of A.alternata;Exogenous SA treated Yali fruit with different concentrations (0,0.02,0.2,2.0 mmol/L),respectively,and inoculated with A.alternata to detect the effect of disease resistance.The results showed that the pathogen of Yali black spot disease was A.alternata. Detached leaves of Yali were inoculated with A.alternata for 72 h,the free state SA content increased from 0 mg/g to 0.02 mg/g and the binding state SA content increased from 0.47 mg/g to 1.55 mg/g,and for 96 h compared with 0 h,the expression of Pbrgene12425, Pbrgene6286, increased 5.48,4.66 times,respectively,the expression of Pbrgene8895 and Pbrgene43605 increased 7.90 and 10.0 times for 120 h.Exogenous 0.2 mmol/L SA significantly increased the resistance of Yali fruit to black spot disease.In the process of Yali resistance to black spot disease,the free state SA content of Yali leaves significantly increased,and the related genes in SA signaling were induced to up-expressed,exogenous 0.2 mmol/L SA significantly increased the resistance of Yali to black spot disease.
鸭梨(Pyrus bretschneideri White Pear Group)原产于我国, 属白梨系统的传统优良品种, 是全国梨三大主要栽培品种之一[1], 是我国第一大出口创汇品种。梨黑斑病是生产上主要病害之一, 该病害是一种世界性病害, 在日本、韩国和我国梨产区发病严重[2, 3]。梨黑斑病主要危害梨树叶片、新梢和果实, 导致树体衰弱, 结果年限缩短[4], 如果防治不及时, 会给梨树生产造成较大危害[5], 严重影响梨果实的产量和品质。
水杨酸(Salicylic acid, SA)是植物重要的防卫激素, 是诱导植物产生抗病反应的重要内源免疫信号[6], 不仅能激活植株产生局部防御反应, 而且能诱导植物获得系统获得性抗性(Systemic acquired resistance, SAR)[7]。外源施加SA可使植物对多种真菌、病毒及细菌引发的病害产生广谱抗性, 其使用方法简单、高效, 无污染, 在植物抗病中发挥着重要作用[8]。研究表明, 外施100 μ g/mL SA可诱导苹果(Malus pumila)抗斑点落叶病, 诱抗效果达到70.9%[9]; 用1.0~10.0 mmol/L SA连续喷雾处理玉米幼苗6 d, 可以明显减轻供试玉米幼苗的病害症状, 表现为病斑数少、病斑面积小, 其中10.0 mmol/L SA防治效果最好, 诱抗效果达56%[10]。0.05 mmol/L SA可显著降低草地早熟禾褐斑病的发病率, 诱抗效果最高达53%[11]。
本研究以河北农业大学实验农场梨园鸭梨叶片和果实为试材, 分离、鉴定了鸭梨黑斑病病原菌的类型, 检测了经黑斑病菌处理鸭梨离体叶片后SA信号通路相关基因的表达量及内源SA含量的变化, 研究了外源SA对鸭梨果实抗黑斑病的影响, 探讨了SA诱导鸭梨抗黑斑病的作用机理, 旨在为研究防治鸭梨黑斑病的生物制剂和抗病育种提供理论依据。
2018年5月从河北农业大学实验农场梨园(保定)采集鸭梨黑斑病病叶。采用常规的组织分离法[12]进行病原菌分离及纯化。
将纯化菌株接种在PDA培养基上, 25 ℃黑暗培养7 d后, 挑取菌丝放在滴有水滴的载玻片上, 将菌丝打散盖上盖玻片, 在光学显微镜下观察分生孢子的形态、颜色、大小及分生孢子梗特征。根据病原菌的菌落形态及颜色特征并参考《真菌鉴定手册》[13]对病原菌进行初步鉴定。
选择健康幼嫩叶片, 将叶片用无菌水冲洗干净, 用75% 酒精将叶片表面消毒, 无菌水冲洗3次后晾干并置于水琼脂培养皿内保湿培养。
分生孢子悬浮液接种法:纯化菌株培养10 d后, 加入5.0 mL无菌水刮洗菌丝, 将分生孢子悬浮液用3层灭菌纱布过滤, 用血球计数板将分生孢子悬浮液配成1.0× 106 cfu/mL浓度, 取20.0 μ L分生孢子悬浮液针刺接种至鸭梨离体叶片。
待接种叶片发病后, 依据柯赫氏法则(Koch's Postulates), 对病原菌重新分离纯化, 观察新分离物是否与接种菌相同。
1.3.1 病原菌基因组DNA的提取 用玻璃棒刮取培养10 d的菌丝, 迅速加入液氮研磨成粉末, 根据真菌基因组DNA快速提取试剂盒(Aidlab, 中国)步骤说明提取菌株基因组DNA, 并将菌株DNA样品置于-20 ℃保存备用。
1.3.2 ITS、HIS、RPB2、ACT基因克隆 利用真菌ITS、HIS、RPB2、ACT多基因综合鉴定法对分离得到的病原菌进行鉴定, 引物序列如表1所示。PCR反应体系:2 × Es Taq MasterMix 10.0 μ L; 菌株基因组DNA 1.0 μ L, 引物各0.5 μ L(10 μ mol/L); ddH2O 8.0 μ L。PCR反应条件:94 ℃预变性2 min; 94 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸15 s, 32个循环; 72 ℃ 2 min, 16 ℃ 保温。
| 表1 研究中所用引物序列 Tab.1 List of primer sequences used in this study |
PCR扩增产物经SanPrep柱式DNA胶回收试剂盒(Sangon Biotech, 中国)回收纯化, 利用pEASY-Blunt Zero Cloning Kit(TransGen, 中国)将回收产物与pEASY-Blunt Zero克隆载体连接转化, 转化子经PCR鉴定后, 选取阳性克隆菌液测序。
1.3.3 病原菌ITS、HIS、RPB2、ACT序列分析 将测序序列与GenBank中已有数据进行同源性对比, 利用Mega 6.0软件中的邻接法(Neighbour-joining methods, NJ)构建多基因聚合的系统发育树, 分析该菌和同属其他菌株的亲缘关系, 再结合病原菌形态、培养特征确定病原菌类型。
将正常培养7 d的黑斑病菌, 用打孔器在菌落边缘均匀打取菌饼, 分别置于不同浓度的SA(0, 0.002, 0.02, 0.20, 2.0, 10.0, 20.0 mmol/L)PDA平板中, 于25 ℃黑暗培养5 d, 观察并记录菌落直径, 计算抑菌率, 每个浓度处理重复6次。
抑菌率=
选择大小一致的鸭梨, 分别在0, 0.02, 0.2, 2.0 mmol/L SA中室温浸泡1 h后刺伤果皮, 接种菌饼, 室温黑暗培养, 接种7, 14 d分别测量病斑直径。每个浓度处理30个鸭梨, 10个鸭梨为一次重复。
鸭梨叶片总RNA的提取, 根据MiniBEST Plant RNA Extraction Kit(TaKaRa, 日本)试剂盒说明步骤提取总RNA。根据FastQuant RT kit(with gDNase)(TIANGEN, 中国)说明书去除基因组DNA及cDNA第一条链合成。实时荧光定量PCR(Real-time quantitative PCR)使用仪器为LightCycler® 96 system(Roche, 瑞士), 荧光染料采用TransStart Top Green qPCR SuperMix(TRANS, 中国), 利用2-Δ Δ Ct方法计算目的基因相对表达量。采用Duncan's test进行显著性分析。Real-time RT-PCR所用引物序列如表1所示。
称取0.5 g样本放入研钵加液氮迅速研磨成粉末, 加入1.0 mL预冷的90%甲醇, 4 ℃浸提, 过夜, 8 000 r/min离心10 min, 吸取上清液至离心管中; 剩余残渣用0.5 mL 90%甲醇浸提2 h, 8 000 r/min离心10 min, 吸取上清液, 将2次上清液合并; 40 ℃ 减压蒸发有机相至剩余0.3 cm水溶液, 加入20.0 μ L 1.0 mg/mL三氯乙酸水溶液, 振荡混匀, 加入1.0 mL环己烷与乙酸乙酯混合液(V:V=1:1)萃取, 重复1次; 将上层有机相转移至新离心管中, 氮吹吹干; 加入0.5 mL甲醇溶液溶解、过滤, 所得溶液即为样本中游离态SA; 在步骤3中下层水相中加入0.5 mL 2 mol/L盐酸溶液, 摇匀, 密闭, 80 ℃水浴1 h; 加入1.0 mL环己烷与乙酸乙酯混合液(V:V =1:1)萃取2次, 同样将上层有机相转移至新离心管中, 氮吹吹干; 加入0.5 mL甲醇溶液溶解、过滤, 所得溶液为样本中结合态SA。
HPLC液相条件:Agilent 2600高效液相色谱, 反向色谱柱Kromasil C18柱(250 mm× 4.6 mm, 5.0 μ m)。配置流动相:流动相A为65%的乙腈溶液(pH值2.8); 流动相B为甲醇。将流动相A和B按照30:70混合进样, 柱温25 ℃, 进样量20.0 μ L, 走样时间5.0 min, 流速1.0 mL/min, 激发波长280.0 nm。
从河北农业大学实验农场梨园采集病叶(图1-A、B), 将患黑斑病的鸭梨叶片进行病原菌分离获得致病菌菌株, 该菌株在PDA培养基上呈近圆形等径辐射生长, 菌株边缘光滑并略显波浪状, 其气生菌丝较发达, 初期白色, 后期逐渐变为灰黑色(图 1-C、D)。菌株培养7 d后产生大量分生孢子, 在光学显微镜下观察病原菌形态(图1-E、F), 分生孢子单生或串生, 淡褐色, 形态多为近球形、倒棒状或倒梨形, 分生孢子表面光滑或具疵, 具有3~11个横膈膜和1~9个纵、斜隔膜, 分隔处略有缢缩, 分生孢子梗直立或略弯, 有分隔, 淡褐色, 常呈分枝或不分枝的孢子链, 有短分枝的孢子链, 作合轴式延伸。根据这些特征, 参照《中国真菌志》及《真菌鉴定手册》初步判定此类病原菌为链格孢属(Alternaria sp.)真菌。
以病原菌菌株基因组DNA为模板, 利用真菌通用引物ACT、HIS、ITS、RPB2进行PCR扩增, 分别得到543, 440, 571, 985 bp的扩增产物(图2-A), 将扩增产物回收, 连接至pEASY-Blunt Zero克隆载体, PCR鉴定正确的克隆菌液送测序, 获得鸭梨黑斑病病原菌的Black spot ACT、Black spot HIS、Black spot ITS、Black spot RPB2基因序列。从GenBank下载链格孢属真菌, 链格孢(Alternaria alternate)、甘蓝链格孢(Alternaria brassicicola)、胡萝卜链格孢(Alternaria dauci)、乔木链格孢(Alternaria arborescens)、细级链格孢(Alternaria tenuissima)、茄链格孢(Alternaria solani)、侵染链格孢(Alternaria infectoria)和云薹链格孢(Alternaria brassicae)的ACT、HIS、ITS、RPB2基因序列与鸭梨黑斑病病原菌的Black spot ACT、Black spot HIS、Black spot ITS、Black spot RPB2基因序列进行多基因系统进化分析, 构建系统发育树(图2-B), 结果表明, 鸭梨黑斑病菌属于链格孢菌属真菌, 同时结合病原菌形态观察及多基因综合鉴定结果, 明确河北农业大学实验农场梨园鸭梨黑斑病病原菌为链格孢属链格孢菌。
鸭梨离体叶片接种黑斑病菌分生孢子悬浮液, 分别观察0, 6, 12, 24, 48, 72, 96, 120 h叶片病斑的发展进程, 并取样。图 3-A、B结果显示, 离体叶片接种黑斑病菌48 h开始出现病斑, 72 h病斑上开始出现白色菌丝, 随着时间增长, 菌丝逐渐增多, 但病斑大小无明显变化, 清水处理为对照组, 无病症产生。发病叶片病斑组织镜检观察该分生孢子和菌丝与接种菌株的形态一致。对发病组织重新进行病原菌分离, 获得与病原菌形态一致的菌株, 完成柯赫氏法则的致病性验证, 同时, 再次验证了本试验接种所用的链格孢菌菌株是引起鸭梨黑斑病的病原菌。
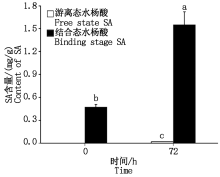
图3结果表明, 鸭梨离体叶片接种黑斑病菌分生孢子悬浮液后48 h开始出现病斑, 72 h病斑面积达到最大, 病斑表面开始出现菌丝, 随着接种时间的延长病斑表面的菌丝逐渐增多。为了进一步明确黑斑病菌的侵染对鸭梨内源SA的影响, 通过HPLC检测了接种0, 72 h鸭梨叶片内SA的含量, 接种72 h鸭梨叶片内游离态SA含量由0 mg/g增至0.02 mg/g, 结合态SA含量由0.47 mg/g增至1.55 mg/g(图4)。结果表明, 鸭梨叶片接种黑斑病菌诱导叶片内源SA含量增加。
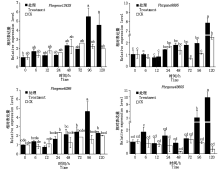
NPR1是SA信号通路中关键的调控因子, NPR1、NPR3、NPR4作为SA的受体, 在植物抗病反应中发挥着重要作用[14]。为了进一步明确黑斑病菌的侵染对鸭梨SA信号通路相关基因的影响, 通过RT-PCR分析表明, 鸭梨离体叶片接种黑斑病菌96 h与接种0 h相比, Pbrgene12425(PbrNPR1-like)、(Pbrgene6286(PbrNPR3-like)表达分别上调5.48, 4.66倍(图5)。PR1是系统获得抗病性的标记基因, Pbrgene8895(PbrNPR4-like)、Pbrgene43605(PbrPR1-like)在黑斑病菌接种120 h与接种0 h相比, 其表达量上调7.90, 10.0倍左右。清水对照试验中, Pbrgene12425、Pbrgene8895、Pbrgene6286、Pbrgene43605相比处理组表达量变化不明显。结果表明, SA信号通路中关键基因Pbrgene12425、Pbrgene6286、Pbrgene8895及Pbrgene43605基因在鸭梨抗黑斑病过程中被诱导上调表达, 参与鸭梨抗病过程。
2.6.1 水杨酸对黑斑病菌菌丝生长的影响 为明确外源SA对黑斑病菌菌丝生长的影响, 将黑斑病菌接种至含不同浓度SA的PDA培养基上培养。当添加的外源SA浓度≤ 0.2 mmol/L时, 5 d后黑斑病菌菌丝生长与对照相比受到轻微抑制, 抑菌率均低于10%; 当SA浓度> 0.2 mmol/L时, 黑斑病菌菌丝生长开始受到明显抑制, 当SA浓度增至10.0 mmol/L及更高浓度时, 菌丝直径明显变小, 抑菌率达29.39%(表2)。结果表明, 外源SA浓度≤ 0.2 mmol/L浓度对黑斑病菌轻微抑制作用, 10.0 mmol/L及以上浓度的SA对黑斑病菌的生长有明显的抑制作用。
| 表2 外源不同浓度水杨酸对黑斑病菌菌丝生长的影响 Tab.2 The effect of different concentrations of SA on the growth of A.alternate |
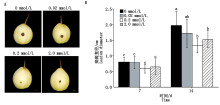
2.6.2 外源水杨酸对鸭梨果实抗黑斑病的影响 为阐明外源SA影响黑斑病菌侵染鸭梨的作用效果, 以不同浓度SA浸泡鸭梨后接种黑斑病菌, 观察接种第7, 14天的表型, 0.2 mmol/L SA处理过的鸭梨产生的病斑明显小于其他浓度处理(图6)。结果表明, 0.2 mmol/L SA处理明显提高了鸭梨对黑斑病菌的抗性。
黑斑病由半知菌亚门丝孢纲丝孢目链格孢属真菌引起, 可通过种子、园间植株病残体等途径传播[15]。黑斑病在梨树上普遍发生, 危害严重。自张志铭等[3]报道河北省鸭梨的黑斑病病原菌鉴定为链格孢菌后, 王宏等[16]、杨晓平等[17]、周求根等[18]、宋博等[19]、朱红艳等[20]报道了不同品种梨黑斑病的病原菌均为半知菌亚门链格孢属真菌。本研究利用组织分离法从河北农业大学实验农场梨园鸭梨患病叶片中分离得到黑斑病病原菌, 通过光学显微镜进行形态观察, 对该病原菌ITS、HIS、RPB2、ACT 4个基因进行克隆并构建其系统进化树, 最后确定鸭梨黑斑病病原菌为链格孢属链格孢菌。
植物与黑斑病菌互作机制较为复杂, 既包括在寄主形态、细胞、生理生化还有分子水平方面的变化过程, 还包括各种信号传递过程。张培岭等[21]在甜瓜采后病害研究中, 6 mmol/L SA处理甜瓜果实后可显著提高果实的CAT、PAL、GLU、CHT、POD、SOD活性, 有效提高了甜瓜果实的抗病性。Liu等[22]利用RNA-Seq研究发现, 菊花在黑斑病菌侵染过程中, SA信号通路相关基因、SA生物合成、JA信号通路相关基因、PTI和防御相关基因参与这一抗病过程。本试验研究表明, 鸭梨叶片在自然状态下植物本身游离态SA含量较低, 而接种黑斑病菌后, 72 h游离态SA含量明显增加, 符合植物与病原菌互作过程中SA作为重要信号分子的特征。
植物体内SA是以结合态SA与游离态SA这2种形式存在, 梁柳[23]报道了植物体内游离态SA与结合态SA相互转化模式, 游离态SA含量积累是源于结合态SA向游离态SA的转化, 而An等[24]研究表明, 游离态SA增加有一部分是来源于SA的生物合成途径。本研究中鸭梨离体叶片接种黑斑病菌后, 游离态SA含量明显增加, 结合态SA含量同时增加, 游离态SA含量的增加不仅来自结合态SA的转化, 有可能病原菌激活了植物体内SA合成途径, 在SA信号传导途径上游可能存在重要的调节机制, 但还需要进一步试验验证。NPR1是植物防卫反应中关键的转录调控辅助因子, 位于SA信号通路下游, NPR1的同源基因NPR3、NPR4作为SA受体[14], 在SA信号传导过程中有重要作用。鸭梨离体叶片接种黑斑病菌分生孢子悬浮液后, Pbrgene12425(PbrNPR1-like)、Pbrgene6286(PbrNPR3-like)在96 h基因表达量上调达最大值, Pbrgene8895(PbrNPR4-like)、Pbrgene43605(PbrPR1-like)基因120 h基因表达量达最大值, 鸭梨在受黑斑病菌侵染后引起植物内源性SA含量升高, NPRs基因表达上调, 进一步引起PR1-like基因表达量增加, 从而增强植物抗病性, 证明SA参与了鸭梨对黑斑病菌侵染的响应。
SA作为抗病诱导剂, 在最适浓度范围内发挥最佳诱抗效果[25]。本研究结果表明, 当SA浓度≤ 0.2 mmol/L时, 对黑斑病菌菌丝的生长没有明显抑制作用, 当SA浓度高于10.0 mmol/L时, 明显抑制黑斑病菌菌丝的生长。在张衍荣等[26]在SA诱导对豇豆抗枯萎菌的研究中有类似的研究结果, 在1.0~10.0 mmol/L内, SA浓度越大对菌丝抑制作用越强, 在不影响豇豆感病品种的幼苗正常生长情况下, 以5.0 mmol/L SA效果最佳。本试验中, 当培养基中SA浓度高于0.2 mmol/L时, 黑斑病菌菌丝生长受到抑制, 主要是因为SA以NaSA形式加入PDA培养基中, 随着培养基中SA浓度增加, 由于盐浓度不断增大从而抑制了病原菌生长, 其本质可能是由于高盐环境抑制了病原菌生长, 当SA浓度为10.0 mmol/L时远高于适宜病原菌生长的临界值, 对病原菌生长有明显的抑制作用。本研究中, 0.2 mmol/L SA处理的鸭梨果实对黑斑病菌的抗性明显增强, 诱抗效果明显, 超过这一浓度范围, 反而对病斑的抑制作用不明显, 该研究结果与王永博[27]外源施加SA对黄金梨抗黑斑病的有效诱导浓度的研究结论一致, 因此, 0.2 mmol/L SA可作为外源SA诱导鸭梨抗黑斑病的最适浓度。
本研究根据病原菌的形态鉴定并结合病原菌多基因序列的系统进化分析, 确定河北农业大学实验农场梨园中鸭梨黑斑病的致病菌是链格孢属链格孢菌; 鸭梨离体叶片接种黑斑病菌分生孢子悬浮液后, 叶片内游离态SA含量明显增加, SA信号通路中的关键基因被诱导表达量显著升高, 参与了鸭梨对黑斑病菌侵染的响应; 外源施加0.2 mmol/L SA具有显著的诱抗效果, 增强了鸭梨对黑斑病菌的抗病性, 在鸭梨黑斑病的防治中具有很好的应用前景。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|