作者简介:孙丽丽(1995—),女,山西临汾人,在读硕士,主要从事小麦遗传育种研究。
半胱氨酸蛋白酶是蛋白质降解过程中的一类水解酶,参与植物的衰老与成熟,在植物生长发育过程中发挥重要作用。基于前期得到的小麦衰老阶段转录组数据中筛选到一个衰老特异的半胱氨酸蛋白酶(SAG39),为了研究 TaSAG39基因在小麦衰老过程中发挥的作用,采用生物信息学分析方法和实时荧光定量(qRT-PCR)技术对 TaSAG39的基因结构和表达模式进行分析。结果表明,其氨基酸序列与小麦祖先种节节麦、野生二粒小麦以及硬粒小麦亲缘关系最近,含有木瓜蛋白酶亚家族特有的活性位点Cys-His-Asn以及EFNIN结构。 TaSAG39-5A、 TaSAG39-5B、 TaSAG39-5D基因组全长分别为1 455,1 435,1 439 bp,编码序列长分别为1 041,1 050,1 038 bp,均含2个外显子和1个内含子;其编码的蛋白分别由346,349,345个氨基酸组成,分子质量约37 ku,等电点5.53~5.67,为稳定的带负电的亲水性蛋白;主要构成元件为无规则卷曲和α-螺旋,在蛋白质N段含有信号肽,具有保守的Inhibitor_I29和Peptidase_C1结构域,含有35~37个磷酸化位点,其中以丝氨酸磷酸化位点和苏氨酸磷酸化位点为主。TaSAG39蛋白可能与半胱氨酸蛋白酶抑制剂以及14-3-3蛋白互作,该基因启动子中含有脱落酸、茉莉酸甲酯、生长素、光、干旱、低温以及胁迫响应等有关的顺式作用元件。qRT-PCR结果证实, TaSAG39基因受自然衰老、黑暗、干旱、茉莉酸甲酯、高温、生长素诱导表达,在自然衰老过程中基因的诱导表达最为显著。
Cysteine protease,a kind of hydrolase in the process of protein degradation,participates in the senescence and maturation of plants and plays an important role in the growth and development of plants.In this study,a senesence-specific cysteine protease(SAG39)was screened from the previously obtained transcriptome data of wheat at senescence stage.In order to study the role of TaSAG39 gene in wheat at senescence,the gene structure and expression pattern of TaSAG39 were analyzed by bioinformatics analysis and Real-time fluorescence quantitative(qRT-PCR)technology.The results showed that the amino acid sequence encoded by the cysteine protease gene SAG39 had the closest relationship with the ancestral species of wheat,such as Aegilops tauschii, Triticum dicoccoides and Triticum durum,and it included the unique active site Cys-His-Asn and EFNIN structures of the papain sub-family.The full-length genomes of TaSAG39-5A, TaSAG39-5B and TaSAG39-5D were 1 455,1 435,1 439 bp,respectively,and the length of the coding sequence was 1 041,1 050,1 038 bp,respectively,with each containing two exons and one intron.The TaSAG39s proteins consisted of 346,349,345 amino acids.With relative molecular weight of about 37 ku and isoelectric point of 5.53—5.67,these proteins were stable negatively charged hydrophilic proteins.Its main components were random coils and α-helix,and there were signal peptides in the N segment of the protein.It had the conserved Inhibittor_I29 and Petidase_C1 domains,and contained 35—37 phosphorylation sites,mainly serine and threonine phosphorylation sites.TaSAG39 protein may interact with cysteine protease inhibitors and 14-3-3 protein.The promoter contained cis-acting elements relative to abscisic acid,methyl jasmonate,auxin,light,drought,low temperature and stress response.The results of qRT-PCR confirmed that gene TaSAG39 was induced to express by natural aging,darkness,drought,methyl jasmonate,high temperature and auxin,among which natural aging was the most significant.
小麦是世界上第一大粮食作物, 目前全球小麦年产量约7亿t[1, 2], 占世界粮食总产量的1/3, 随着人口总量的持续增加, 全世界发展中国家对小麦产量的需求还将持续增加。叶片衰老是植物生长发育的最后一个阶段, 过早启动衰老进程会对植物的生长发育产生不良影响[3]。对于小麦而言, 叶片衰老与籽粒灌浆同步进行, 适当地延缓衰老能够提高小麦产量、改善品质[4, 5, 6, 7]; 然而叶片衰老受基因的精细调控[8, 9]。因此, 挖掘衰老相关基因, 解析衰老分子机制, 对于提高作物的产量和改善品质具有重要的意义。
半胱氨酸蛋白酶(Senesence-specific cysteine protease, SAG39)又叫硫醇蛋白酶, 是目前衰老相关基因(SAG)研究的热点之一, 不同植物在自然衰老或诱导衰老过程中的基因表达分析表明, 半胱氨酸蛋白酶始终是最丰富的一类蛋白酶[10]。19世纪40年代以来, 已有多种半胱氨酸蛋白酶从不同植物中被分离鉴定[11]。Beyene等[12]利用快速扩增cDNA末端(RACE)的方法, 从衰老和非衰老烟叶中分离到2个cDNA, 命名为NtCP1和NtCP2, 通过Northern杂交检测成熟绿色叶片和衰老叶片NtCP1和NtCP2的表达, 结果表明, NtCP1主要在老化的叶片中表达, 被认为是衰老特异基因, 而NtCP2的表达只在成熟的绿叶中被检测到, 被认为有可能与细胞程序性死亡相关。Liu等[13]分离了水稻中衰老相关基因OsSAG39的启动子, 结果发现, 随着叶龄的增加叶片逐渐进入衰老阶段, OsSAG39的表达量也逐步增加, 衰老晚期时达到最大值, 通过对OsSAG39的启动子进行GUS表达分析也确定了该基因的衰老特异性。朱海生等[14]从草莓中克隆到半胱氨酸蛋白酶基因FaCP, 分析发现, 在果实成熟及叶片衰老过程中FaCP基因表达量显著上升, 表明FaCP可能参与调控草莓果实的成熟及叶片衰老。同时研究发现, 拟南芥中的SAG12[15]、玉米中的See1[16]、油菜中的BnSAG12-2[17]、烟草中的NtCP-23[18]等衰老相关基因均编码半胱氨酸蛋白酶。目前, 关于半胱氨酸蛋白酶在小麦中的研究主要集中于干旱[19, 20]和抗病[21]方面, 而在小麦衰老过程中发挥的作用尚不清楚。
基于山西农业大学小麦育种课题组前期对2个不同持绿类型小麦品种晋麦39(非持绿型)和太绿113(持绿型)花后不同时期旗叶进行转录组测序, 差异表达分析发现一个被注释为衰老特异的半胱氨酸蛋白酶的转录本在衰老前期该基因表达量很低, 但在衰老过程中其表达量极显著升高, 且在非持绿型品种中的表达量显著高于持绿型品种[22], 初步推测TaSAG39与小麦叶片衰老有关。
为了进一步探索TaSAG39的功能, 本研究对该基因进行系统的生物信息学分析, 并对不同胁迫下和叶片衰老过程中该基因的表达模式进行分析, 以期为后期基因功能研究和分子育种提供依据。
供试小麦品种晋麦39, 主要用于不同胁迫处理下TaSAG39的表达模式分析; 供试小麦品种烟农19, 主要用于自然衰老过程中TaSAG39的表达模式分析。
1.2.1 材料处理 挑选籽粒大小一致且饱满的晋麦39种子, 用1%的NaClO溶液浸泡15 min后, 用无菌水冲洗4~5次, 冲洗干净后室温下用自来水浸泡24 h后, 移入网盒(下有托盘)中, 采用1%的花无缺培养, 每天更换培养液。置于人工气候培养箱中培养:温度22 ℃, 相对湿度70%, 光照强度9 000 lx, 16 h光照/8 h黑暗。培养至一叶一心期(7 d左右), 对幼苗分别进行不同胁迫处理(黑暗、34 ℃高温、16.1% PEG、50 μ mol/L MeJA、50 μ mol/L IAA和250 mol/L NaCl), 并分别于诱导后0, 1, 2, 3, 6, 12, 24, 48, 72 h取新鲜叶片组织, 经液氮速冻后保存于-80 ℃, 用于提取RNA。
用于自然衰老表达模式分析的烟农19于2019年度种植在山西农业大学农作站小麦试验基地(北纬37° 25', 东经112° 25'), 分别在花后0, 7, 10, 13, 16, 19, 22, 24, 30 d取完整旗叶, 经液氮速冻后保存于-80 ℃, 用于提取RNA。
1.2.2 总RNA的提取及cDNA的合成 利用TRIzol法提取小麦叶片总RNA, 然后根据全式金生物公司的反转录试剂盒说明书将RNA反转录为cDNA后, 保存于-80 ℃, 用于后续荧光定量试验。
1.2.3 生物信息学分析 将转录组数据中注释为SAG39的转录本序列在小麦基因组URGI数据库(https://urgi.versailles.inra.fr/blast/)中BLAST获得TaSAG39-5A、TaSAG39-5B、TaSAG39-5D等3个同源基因的cDNA和启动子候选序列。利用NCBI-ORF finder(https://www.ncbi.nlm.nih.gov/orffinder/)工具获取基因的开放阅读框, 并将其翻译成氨基酸序列; 将得到的氨基酸序列通过NCBI网站中的BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)功能, 获得其他物种中SAG39的氨基酸序列, 用MEGA-X软件对不同物种间SAG39构建系统进化树, 用DNAMAN软件进行序列比对; 利用在线工具Expasy-ProtParam(https://web.expasy.org/protparam/)进行蛋白质的基本理化性质分析; 利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL(https://swissmodel.expasy.org/)分别对蛋白质二级结构和三级结构进行预测; 利用SignalP 5.0(http://www.cbs.dtu.dk/services/SignalP/index.php)和NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)预测分析蛋白质的信号肽以及蛋白质磷酸化位点; 用MEME(https://meme-suite.org/meme/tools/meme)分析蛋白质的保守基序; 通过NCBI网站的Conserved Domain Database数据库(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)及Pfam数据库(http://pfam.xfam.org/)分析蛋白质的保守结构域; 用在线工具STRING(https://string-db.org/)进行蛋白质互作网络构建; 利用在线工具PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析TaSAG39基因启动子区的顺式作用元件。
1.2.4 实时荧光定量PCR 用Primer 5.0软件设计实时荧光定量PCR的引物, 其中, TaSAG39上游引物5'-AGGGTCTTGCGGCTGCTG-3', 下游引物5'-TCGAAGGCGTTGTCCATGAG-3'。内参基因选择小麦Actin基因, 上游引物5'-CTCCCTCACAACAACAACCGC-3', 下游引物5'-TACCAGGAACTTCCATACCAAC-3'。使用TaKaRa公司的荧光定量试剂盒进行荧光定量PCR, 每个样品重复3次, 按照公式2-Δ Δ Ct计算目的基因的表达量。
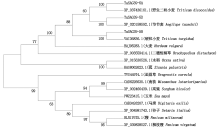
根据TaSAG39基因编码的蛋白序列, 利用NCBI数据库中的BLAST搜索功能, 筛选得到其他物种中SAG39的氨基酸序列。运用MEGA-X软件的最大似然法构建系统发育进化树, 结果表明(图1), 小麦TaSAG39-5A、TaSAG39-5B、TaSAG39-5D与其他单子叶植物节节麦、野生二粒小麦、硬粒小麦、大麦、二穗短柄草、菰、水稻中的SAG39聚为一类, 画眉草、南荻、高粱、玉米、马唐、谷子、柳枝稷、稷中的SAG39聚为一类。同时发现, TaSAG39-5A、TaSAG39-5B、TaSAG39-5D基因所编码的氨基酸在进化上与节节麦、野生二粒小麦、硬粒小麦聚为一类, 说明其亲缘关系最近, 表明该蛋白氨基酸序列在小麦的进化过程中具有较高的保守性。除此之外, 其与大麦中的SAG39亲缘关系最近。进一步对TaSAG39蛋白进行多重比对同样发现(图2), 不同物种中的SAG39氨基酸序列具有典型EFNIN结构和催化三联体(Cys-His-Asn), 这些结构是木瓜蛋白酶家族基因的典型特征[23]。同时比对发现, 不同物种SAG39氨基酸序列中均含有相同的2个保守结构域组织蛋白酶前体抑制结构域I29(Inhibitor_I29)和木瓜蛋白酶家族半胱氨酸蛋白酶Pept_C1结构域(Peptidase_C1)。
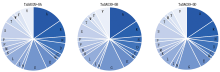
预测TaSAG39蛋白质理化性质, 结果显示, TaSAG39蛋白编码345~349个氨基酸, 在3个同源蛋白中含量最高的氨基酸均为丙氨酸, TaSAG39-5A为15.3%、TaSAG39-5B为15.5%、TaSAG39-5D为15.4%, 在TaSAG39-5A、TaSAG39-5D中含量最低的为谷氨酰胺, TaSAG39-5B中含量最低的为组氨酸, 均为1.4%(图3)。3个同源蛋白的分子质量约为37 ku, 理论等电点为5.53~5.67, 为酸性蛋白; 带正电残基(Arg+Lys)为35~36, 带负电残基(Asp+Glu)为40~42, 表明该蛋白在中性条件下带负电; 蛋白质的不稳定系数为34.59~38.07, 属于稳定蛋白; 脂肪指数约为71, 亲水性约为-0.174, 表明该蛋白为亲水性蛋白(表1)。可以看出, 这3个同源蛋白质的理化性质差异不大。
| 表1 TaSAG39蛋白质理化性质 Tab.1 Physicochemical properties of TaSAG39 protein |
预测小麦TaSAG39s蛋白的二级结构, 如图4所示, TaSAG39s蛋白的二级结构均含有α -螺旋、β -转角、无规则卷曲和延伸链, 且占比最大的均为无规则卷曲, 为40.97%~42.61%; 其次为α -螺旋, 介于35.26%~38.68%; 延伸链所占比例介于13.91%~16.47%; 占比最少的为β -转角, 为6.02%~6.96%。由此可见, 小麦TaSAG39蛋白的主要构成元件为无规则卷曲, 构成酶活性部位或蛋白质特异的功能部位, 而α -螺旋为次要构成元件来连接其他二级结构。
对TaSAG39s蛋白质的三级结构进行预测, 结果显示(图5), 3个同源蛋白的同源建模的参考模板均为SMTL中的6u7d.1.A, GMQE约为0.72, QMEAN4约为0.75, 表明该结果可用。结果显示, 该蛋白的三级结构主要由无规则卷曲和α -螺旋构成, 与二级结构预测结果一致。且发现TaSAG39-5A与TaSAG39-5D的三级结构基本一致, 而TaSAG39-5B的三级结构略有不同, 但是基本一致。
TaSAG39的3个同源蛋白质的信号肽预测结果一致, 分析结果显示(图6), 其蛋白质N端含有一段18个氨基酸残基的信号肽序列, 序列为MSRSTLIILALLAVSSAVA, 推测TaSAG39基因编码的蛋白可能为分泌蛋白。
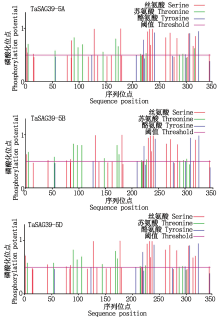
磷酸化位点分析结果显示(图7), TaSAG39s蛋白有35~37个磷酸化位点, 其中, 丝氨酸磷酸化位点最多, 约18个, 苏氨酸磷酸化位点占比第2(约13个), 酪氨酸磷酸化位点最少, 约6个; 且其中有4个丝氨酸磷酸化位点的值均高于0.980, 约达标准值的2倍。因此, 推测该基因通过丝氨酸磷酸化修饰调控为主、苏氨酸磷酸化修饰调控为辅来实现其功能。
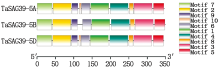
为了更好地了解TaSAG39基因的功能, 对小麦TaSAG39蛋白的保守基序、结构域以及基因结构进行分析, 结果发现(图8), 在小麦TaSAG39蛋白中含有10种保守基序, 且除TaSAG39-5B中缺失一个Motif 10外, 在3个同源蛋白中这些保守基序基本一致, 在Pfam上预测发现在Motif 1、Motif 3、Motif 4中均存在Peptidase_C1结构域, Motif 2中存在Inhibitor_I29结构域。同时将3个基因组的蛋白序列在NCBI中的Conserved Domain Database进行保守结构域预测, 结果表明(图9), TaSAG39的3个基因组均包含2个保守结构域组织蛋白酶前体抑制结构域I29(Inhibitor_I29)和木瓜蛋白酶家族半胱氨酸蛋白酶Pept_C1结构域(Peptidase_C1), 预测结果与保守基序预测结果相对应。分析TaSAG39的基因结构发现(图10), 该基因位于第5号染色体上, 3个基因组均包含2个外显子和1个内含子, 其中TaSAG39-5A全长1 455 bp, 编码区1 041 bp; TaSAG39-5B全长1 435 bp, 编码区1 050 bp; TaSAG39-5D全长1 439 bp, 编码区1 038 bp。
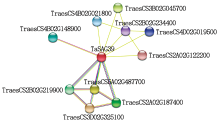
通过在线工具STRING构建TaSAG39蛋白互作网络关系, 结果发现, TaSAG39蛋白与2个半胱氨酸蛋白酶抑制剂(TraesCS3D02G325100、TraesCS5A02G487700)、2个半胱氨酸蛋白酶RD19D(TraesCS2A02G187400、TraesCS2B02G219900)、4个糖苷水解酶(TraesCS3B02G045700、TraesCS4B02G021800、TraesCS4D02G019500、TraesCS2A02G122200)、1个14-3-3蛋白(TraesCS4B02G148900)和1个未注释的蛋白(TraesCS2B02G234400)互作, 其中TaSAG39与半胱氨酸蛋白酶抑制剂和半胱氨酸蛋白酶RD19D有多种证据表明存在相互作用关系(图11)。
利用PlantCARE对TaSAG39的3个基因组起始密码子上游2 000 bp的序列进行顺式作用元件分析, 结果表明(图12), TaSAG39的3个基因组启动子均存在着大量的顺式作用元件, 如响应脱落酸的顺式作用元件ABRE, 光胁迫响应元件G-box、GT1-motif、Sp1, 茉莉酸甲酯响应元件CGTCA-motif、TGACG-motif, 干旱响应元件MYC、DRE core, 生长素响应元件TGA-element, 高温响应元件STRE, 低温响应元件LTR、厌氧诱导响应元件ARE, 其中光响应元件和干旱响应元件最多, 茉莉酸甲酯、脱落酸以及温度响应元件相对较多; 此外发现, TaSAG39-5A、TaSAG39-5D基因组启动子区还含有与分生组织表达相关的顺式作用元件CAT-box, 表明TaSAG39可能参与小麦生长发育的调节及非生物胁迫响应。
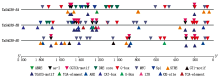
为了进一步明确小麦TaSAG39基因的潜在功能, 根据该基因启动子上的顺式作用元件, 通过qRT-PCR分析其在自然衰老及非生物胁迫下的表达情况, 从图13可以看出, 在自然衰老及6种非生物胁迫下, TaSAG39的表达量均发生了明显变化。在自然衰老过程中, 花后前期TaSAG39的表达量没有明显的变化, 在花后30 d其表达量急剧增高, 达到花后0 d的360倍; 在黑暗处理中, 随着处理时间的延长, TaSAG39的表达呈现先下降后上升再下降的趋势, 且在处理6 h基因的表达量达到最高, 为处理前的4.5倍; 在PEG模拟的干旱处理下, 胁迫2 hTaSAG39的表达量达到对照的14倍, 在随后的胁迫时间内表达量呈现下降趋势; 在生长素(IAA)处理下, 除胁迫2 h TaSAG39的表达量低于对照外, 其余时间段均高于对照且呈现出先上升后下降的趋势, 12 h达到最大值; 在茉莉酸甲酯(MeJA)和高温胁迫下, TaSAG39的表达量均呈上升— 下降— 上升— 下降— 上升的趋势, 分别在24, 12 h表达量达到最大值, 分别为对照的3.9, 2.1倍; 在NaCl处理下, 除72 h外, TaSAG39整体表现出表达量下降趋势, 且在处理2 h降低至临界值, 为处理前的0.003倍左右。
半胱氨酸蛋白酶是一类重要的蛋白水解酶, 广泛参与植物的各种生理过程, 如种子萌发、低温、干旱、盐等环境胁迫以及衰老等[24, 25]。因此, 研究半胱氨酸蛋白酶对于研究植物抗逆和植物生长发育过程具有重要作用。
本研究对小麦中半胱氨酸蛋白酶基因TaSAG39进行分析, 结果发现, TaSAG39蛋白为稳定的带负电的亲水性蛋白, 且该蛋白主要由无规则卷曲和α -螺旋构成, 与前人报道相一致[26]。此外, 氨基酸序列中含有木瓜蛋白酶亚家族共有的活性位点Cys-His-Asn以及EFNIN结构域, 其中氨基酸序列N端有18个氨基酸残基编码的信号肽以及一个肽酶抑制剂结构域, C端有木瓜蛋白酶亚家族的保守结构域, 与前人报道木瓜蛋白酶的氨基酸序列从N端到C端划分为信号肽序列、前体肽序列和成熟酶序列3个区域一致[27]。
启动子是基因表达调控的重要元件, 而顺式作用元件作为启动子中与转录因子结合的一段特异序列, 其在启动子中的类型、数目以及它们之间的顺序和距离都会影响到基因的表达效率及强弱[28], 因此, 分析基因启动子所含顺式作用元件可为研究基因的结构、表达模式和功能提供一定的参考。本研究对TaSAG39启动子上的顺式作用元件进行分析发现, 该基因的启动子上包含大量的非生物胁迫和激素响应的顺式作用元件, 如干旱、光、热、茉莉酸甲酯、生长素以及脱落酸等。前人研究表明, 在植物中半胱氨酸蛋白酶基因启动子区中常常含有许多胁迫响应元件, 如脱水响应元件、脱落酸响应元件等[23]。本研究发现, TaSAG39在自然衰老、黑暗、干旱、高温、盐胁迫和茉莉酸甲酯以及生长素处理下可以被不同程度地诱导表达, 其中在自然衰老、黑暗、干旱、高温胁迫以及茉莉酸甲酯、生长素激素处理下上调表达, 与小麦中其他编码半胱氨酸蛋白酶的基因TaCP1[19]、TaCP3[20]表达模式相似; 在盐胁迫下表达受到抑制, 与柑橘中CsCysP研究结果相反[29]。推测其原因可能是因为不同基因启动子中所含有顺式作用元件的种类和个数不同, 因此其响应胁迫时基因的表达模式也不同。
本研究通过蛋白互作分析发现, TaSAG39可能与半胱氨酸蛋白酶抑制剂、半胱氨酸蛋白酶RD19D、糖苷水解酶以及14-3-3蛋白之间发生互作。半胱氨酸蛋白酶抑制剂可通过与半胱氨酸蛋白酶的活性位点直接相互作用来抑制半胱氨酸蛋白酶的活性, 进一步阻止蛋白质的水解, 参与环境胁迫应答、细胞程序性死亡以及新陈代谢的调节[30], 推测TaSAG39可能与半胱氨酸蛋白酶抑制剂相互作用来共同调节小麦叶片衰老及胁迫响应。Kunert等[31]研究也表明, 在菠菜的衰老叶片中半胱氨酸蛋白酶抑制剂可与半胱氨酸蛋白酶相互作用来参与菠菜衰老过程。14-3-3蛋白是一个特殊的磷酸化结合蛋白, 能够与含有丝氨酸和苏氨酸磷酸化位点的蛋白质相互作用, 在植物激素信号转导及碳代谢中发挥着重要作用[32, 33]。对TaSAG39s编码的蛋白质进行磷酸化分析发现, 其包含大量的丝氨酸和苏氨酸磷酸化位点, 推测14-3-3蛋白可能与TaSAG39蛋白结合进而参与植物激素信号转导及碳代谢, 其还有待于进一步深入研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|